CYTOSKELETON NEWS – Apr 2023 |Manipulation Of Small GTPases By Pathogenic Bacteria
病原性細菌による低分子量GTPaseの操作
低分子量Gタンパク質としても知られる低分子量GTPase は、事実上すべての細胞内プロセスにおいて役割を果たす調節因子の大きなファミリーです。これらは、基本的に分子スイッチとして機能し、GTPのγ-リン酸基の有無によって誘導される構造変化によって、GDP結合の不活性状態(「オフ」)とGTP結合の活性状態(「オン」)のいずれかをとります1 。ヒトでは低分子量GTPaseは約150のメンバーが含まれており、その配列と構造に基づいて5つのサブファミリー:Ras、Rho、Arf、Rab、Ranに分類されます2。
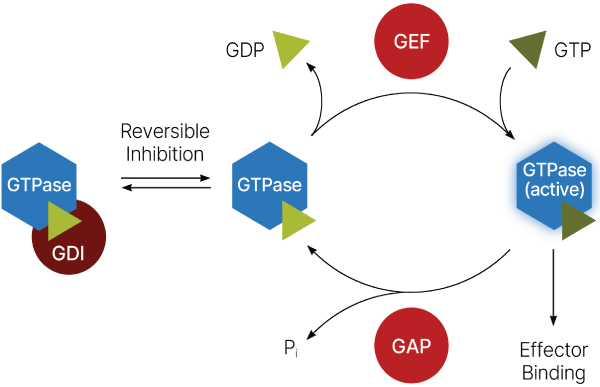
これらのタンパク質の活性は一連の複雑なメカニズムによって厳密に制御されています3(図1)。「オフ」状態から「オン」状態への切り替えは、グアニンヌクレオチド交換因子(GEF)によって仲介されます。一方で、GTPアーゼ活性化タンパク質(GAP)は、通常は遅い内在性GTPアーゼ活性を刺激し、速やかに「オフ」状態へ戻すことが可能です。この状態では、低分子量GTPaseがグアニン解離阻害剤(GDI)に結合してGEFとの相互作用を阻害し、活性化を防ぐことがあります。この緻密な制御システムは様々なタンパク質間相互作用や翻訳後修飾(PTM)によってさらに増強されます4。その結果、非常に複雑な制御ネットワークが形成され、その機能は過去数十年にわたり熱心に研究されてきました。
その重要性を考えれば多くの病原性細菌が、低分子量GTPase・シグナル伝達を利用して、宿主組織に侵入し、コロニーを形成していることは驚くべきことではありません。本稿ではこれらの病原体が宿主の細胞プロセスを攪乱し、自分たちに有利になるように利用する多様な戦略のほんの一部を紹介します。
宿主細胞侵入のためのRho GTPaseの活性化
Rac1、Cdc42、RhoAなどの膜アンカー型RhoファミリーGTPaseは、アクチン細胞骨格形成の重要な調節因子です。これらの因子はWASPとWAVEタンパク質の機能を調節し、アクチン重合Arp2/3複合体のリクルートと活性化を誘導します5。通常、WASPはArp2/3を活性化するVCAモチーフがGタンパク質結合ドメイン(GBD)によって保護された自己抑制フォールドを採用します。後者がCdc42-GTPと結合すると、VCAが解放されてArp2/3と結合し6、Rac1-GTPも同様にN-WASPとWAVEを活性化します7,8。多くの病原性細菌は、RhoファミリーGTPaseの機能を破壊して細胞骨格のリモデリングを行い、宿主細胞への侵入を可能にします。例えば、食中毒の主な原因とされるCampylobacter jejuniは、2つの外膜タンパク質CadFとFlpAを介してフィブロネクチンと結合することにより、Rac1の上流にあるインテグリンを介したシグナル伝達カスケードを乗っ取ります9。これにより、Rac1を活性化する宿主 GEF(DOCK1およびTIAM1)の下流のリクルートメントを誘導し、ラッフル膜の形成と細菌の侵入を促進します。これに一致して、Rac1またはそのGEFをノックダウンすると、ヒト上皮細胞へのC.jejuniの侵入を大幅に減弱させました。
一部の細菌は膜レセプターを利用するのではなく、注射器のようなIII型分泌システム(T3SS)を用いてエフェクタータンパク質を宿主細胞の細胞質に直接注入します。このメカニズムは、モデル病原体として広範に研究されているサルモネラ属菌(胃腸炎および腸チフス)によって例証され、細菌の内在化と細胞内生存を可能にするために低分子量GTPase 機能を妨害する多数のエフェクターを分泌することが示唆されました5。サルモネラ菌のセクレトームには、Cdc42とRac110を標的としてアクチン重合と膜リモデリングを促進し、宿主細胞への侵入を促進する真核生物のGEF模倣体であるSopEが含まれています。
その後の研究によりWAVEの活性化にはRac1だけでなく、Arfファミリーの低分子量GTPaseも必要であることが明らかになりました。サルモネラは第二のエフェクターであるSopBの作用により、宿主のGEFであるシトヘシン-2(ARNO)をリクルートしてArf1を活性化し、SopEの機能を補完します11,12。さらにSopEは低分子量GTPaseであるRalAを活性化し、侵入部位にエキソシスト複合体をリクルートして膜の拡張をさらに促進することが知られています13。驚くべきことに、この細菌は侵入後にCdc42とRac1に対するGAP活性を持つ別のタンパク質SptPを分泌し、膜リモデリングプロセスをダウンレギュレートして正常な細胞骨格形態を回復させます14,15。
居心地の良さを追求する!?:細菌によるRabとArf GTPaseのハイジャック
病原性サルモネラは一旦内在化すると、サルモネラ含有液胞(SCV)と呼ばれる細胞内封入体の中で生存・増殖を続け、増殖中の細菌を宿主の防御から保護します。このニッチを確立し維持するために、サルモネラはさらにT3SSエフェクターを分泌し、細胞内輸送の調節因子として確立されているRabファミリーの低分子量GTPaseの機能を妨害します4。 最初に、細菌のエフェクター SopB は Rab5a をリクルートして、EEA1 のロードを含む初期エンドソーム特性を SCV に付与します16。Rab5aは初期エンドソームの融合と後期エンドソームへの転換を仲介するため、成熟したSCVはその後、Rab7とRab9を含む後期エンドソームマーカーを獲得しますが、さらなる T3SS エフェクターがその特性を変更して細菌の生存を可能にします。例えばSifAはそのエフェクタータンパク質であるPLEKHM1と結合することによって、さらにRab7を捕捉しファゴリソソーム膜をSCVとの融合に転用して液胞を拡大します17。一方、SopD2 は Rab7 を介した RILP と FYCO1 のリクルートをブロックして SCV のリソソームへの輸送を防ぎ16、 SifA は PLEKHM2 と結合して Rab9 との相互作用をブロックします。これによりマンノース-6-リン酸レセプター(M6PRs)のSCV膜への輸送が停止し、リソソーム酵素の取り込みが阻害され、常在細菌が加水分解攻撃から保護されます18。
同様にChlamydia trachomatisは、70種類以上のT3SSタンパク質を介して複数の経路を操作することにより細胞内で増殖します19。クラミジアは、IPAM/CT223を用いて宿主の微小管組織を破壊し、その新生液胞をゴルジ体の隣に配置させた後、InaC/CT813を分泌して、Arf1とArf4 GTPaseを封入体膜にリクルートします。これによって安定化した微小管の翻訳後修飾(PTM)が誘導され20、液胞が所定の位置に「固定」されるように見えます。他の偏性細胞内細菌と同様に、C. trachomatisはゲノムが小さく、多くの代謝遺伝子を持たないため、宿主細胞からの栄養に依存しています。そのため、再構築された微小管ネットワークがゴルジ体由来の小胞と融合することで、細菌は必須脂質を得ることができます21。別のクラミジアエフェクターである CT229/CpoS は、いくつかの Rab GTPase に結合する能力を通じて、さらなる栄養素を隔離します。例えば、Rab4 および Rab35 との相互作用により、トランスフェリンを含むリサイクル小胞を捕捉し、クラミジア感染の増殖に必須の栄養素である鉄を獲得することが可能になります22。
オートファジーの転換:利用するか回避するか?
オートファジーの制御には、複数のRab GTPaseが関与しており23、様々な細菌が異なる方法でオートファジーを操作します。細胞内病原体であるCoxiella burnetii(Q熱)とEhrlichia chaffeensis(ヒト単球性エーリキア症)は、いずれも、オートファゴソームを栄養素や膜物質の源として補足し、細菌の増殖と液胞の拡大を促進すると考えられています。C. burnetiiは、T4SSを介したCvpFの送達によってこれを実現します。CvpFはRab26を封入体にリクルートするエフェクターです24。この低分子量GTPaseは、最近同定されたもので、いくつかの研究でオートファゴソームの形成を促進することが示されています25-27。E. chaffeensisの場合、分泌因子 Etf-1 は Rab5a とそのエフェクター PIK3C3 の両方に結合します。これによってオートファゴソームの生成が促進され、細菌封入体と結合し、表面上は細胞質の栄養分を複製液胞に送り込んでいます28。
オートファジーもまた、侵入してくる細胞内細菌に対する宿主の重要な防御機構ですが、特定の病原体によって破壊されることがあります。例えばListeria monocytogenes(リステリア菌)はRab5aをADPリボシル化する酵素を分泌し、GEF機能を阻害してその活性化を防止します。これにより、Rab5a を介したファゴソームとリソソームの融合が阻害され、細菌は殺菌を回避できます29。同様にShigella flexneri (赤痢菌)は、T3SSエフェクターであるVirAを介してオートファジーを解除します。VirAはRab1のGAPとして機能し、Rab1を「オフ」状態に保ち、オートファゴソームの形成を阻止します30。
最近の動向と今後の展望
細菌の分泌系から放出される病原性因子の機能的範囲が広いことを考えると、これらのエフェクター、あるいはT3SSそのものを標的とすることが新たな研究戦略として考えられます31。これは、抗生物質耐性の増大や既存薬剤のその他の副作用に対する潜在的な解決策となる可能性があり32、いくつかの新薬候補が前臨床開発中です。他の研究では、Mycoplasma pulmonisのSmcタンパク質に低分子量GTPアーゼ様ドメインが同定され、これは、構造的にも機能的にもSopE様GEFに類似しており、Rac1を活性化して細胞の移動と増殖を促進することがわかっています。長期的なマイコプラズマ感染症は、現在のところ解決が困難とされていますが、複数のがんタイプのリスク上昇と関連していることが報告されています34。そのため、これらの病原体が細菌のような病原性因子を利用している可能性は、将来のがん治療や予防の有望な新しい手段となるかもしれません。
■参考文献
- Toma-Fukai S, Shimizu T. Structural insights into the regulation mechanism of small GTPases by GEFs. Molecules. 2019;24(18):3308. https://doi.org/10.3390/molecules24183308.
- Paone S, Olivieri A. Role of host small GTPases in Apicomplexan parasite infection. Microorganisms. 2022;10(7):1370. https://doi.org/10.3390/microorganisms10071370.
- Corry J, Mott HR, Owen D. Activation of STAT transcription factors by the Rho-family GTPases. Biochem Soc Trans. 2020;48(5):2213–2227. https://doi.org/10.1042/bst20200468.
- Cherfils J, Zeghouf M. Regulation of small GTPases by GEFs, GAPs, and GDIs. Physiol Rev. 2013;93(1):269–309. https://doi.org/10.1152/physrev.00003.2012.
- Rottner K, Stradal TEB, Wehland J. Bacteria–host-cell interactions at the plasma membrane: Stories on actin cytoskeleton subversion. Dev Cell. 2005;9(1):3–17. https://doi.org/10.1016/j.devcel.2005.06.002.
- Higgs HN, Pollard TD. Activation by Cdc42 and PIP2 of Wiskott–Aldrich syndrome protein (WASP) stimulates actin nucleation by Arp2/3 complex. J Cell Biol. 2001;150(6):1311–1320. https://doi.org/10.1083/jcb.150.6.1311.
- Tomasevic N, Jia Z, Russell A, Fujii T, Hartman JJ, Clancy S, Wang M, Beraud C, Wood KW, Sakowicz R. Differential regulation of WASP and N-WASP by Cdc42, Rac1, Nck, and PI(4,5)P2. Biochemistry. 2007;46(11):3494–3502. https://doi.org/10.1021/bi062152y.
- Ding B, Yang S, Schaks M, Liu Y, Brown AJ, Rottner K, Chowdhury S, Chen B. Structures reveal a key mechanism of WAVE regulatory complex activation by Rac1 GTPase. Nat Commun. 2022;13(1):5444. https://doi.org/10.1038/s41467-022-33174-3.
- Boehm M, Krause-Gruszcyznska M, Rohde M, Tegtmeyer N, Takahashi S, Oyarzabal OA, Backert S. Major host factors involved in epithelial cell invasion of Campylobacter jejuni: Role of fibronectin, integrin β1, FAK, Tiam-1, and DOCK180 in activating Rho GTPase Rac1. Front Cell Infect Microbiol. 2011;1:17. https://doi.org/10.3389/fcimb.2011.00017.
- Friebel A, Ilchmann H, Aepfelbacher M, Ehrbar K, Machleidt W, Hardt WD. SopE and SopE2 from Salmonella typhimurium activate different sets of RhoGTPases of the host cell. J Biol Chem. 2001;276(36):34035–34040. https://doi.org/10.1074/jbc.m100609200.
- Humphreys D, Davidson A, Hume PJ, Koronakis V. Salmonella virulence effector SopE and host GEF ARNO cooperate to recruit and activate WAVE to trigger bacterial invasion. Cell Host Microbe. 2012;11(2):129–139. https://doi.org/10.1016/j.chom.2012.01.006.
- Singh V, Davidson AC, Hume PJ, Humphreys D, Koronakis V. Arf GTPase interplay with Rho GTPases in regulation of the actin cytoskeleton. Small GTPases. 2019;10(6):411–418. https://doi.org/10.1080/21541248.2017.1329691.
- Nichols CD, Casanova JE. Salmonella-directed recruitment of new membrane to invasion foci via the host exocyst complex. Curr Biol. 2010;20(14):1316–1320. https://doi.org/10.1016/j.cub.2010.05.065.
- Galán JE, Zhou D. Striking a balance: Modulation of the actin cytoskeleton by Salmonella. Proc Natl Sci U S A. 2000;97(16):8754–8761. https://doi.org/10.1073/pnas.97.16.8754.
- Stebbins CE, Galán JE. Modulation of host signaling by a bacterial mimic: Structure of the Salmonella effector SptP bound to Rac1. Mol Cell. 2000;6(6):1449–1460. https://doi.org/10.1016/s1097-2765(00)00141-6.
- Knuff K, Finlay BB. What the SIF is happening—the role of intracellular Salmonella-induced filaments. Front Cell Infect Microbiol. 2017;7:335. https://doi.org/10.3389/fcimb.2017.00335.
- McEwan DG, Richter B, Claudi B, Wigge C, Wild P, Farhan H, McGourty K, Coxon FP, Franz-Wachtel M, Perdu B, Akutsu M, Habermann A, Kirchof A, Helfrich MH, Odgren PR, Van Hul W, Frangakis AS, Rajalingam K, Macek B, Holden DW, Bumann D, Dikic I. PLEKHM1 regulates Salmonella-containing vacuole biogenesis and infection. Cell Host Microbe. 2015;17(1):58–71. https://doi.org/10.1016/j.chom.2014.11.011.
- McGourty K, Thurston TL, Matthews SA, Pinaud L, Mota LJ, Holden DW. Salmonella inhibits retrograde trafficking of mannose-6-phosphate receptors and lysosome function. Science. 2012;338(6109):963–967. https://doi.org/10.1126/science.1227037.
- Bugalhão JN, Mota LJ. The multiple functions of the numerous Chlamydia trachomatis secreted proteins: The tip of the iceberg. Microb Cell. 2019;6(9):414–449. https://doi.org/10.15698/mic2019.09.691.
- Haines A, Wesolowski J, Ryan NM, Monteiro-Brás T, Paumet F. Cross talk between ARF1 and RhoA coordinates the formation of cytoskeletal scaffolds during Chlamydia infection. mBio. 2021;12(6):e0239721. https://doi.org/10.1128/mbio.02397-21.
- Al-Zeer MA, Al-Younes HM, Kerr M, Abu-Lubad M, Gonzalez E, Brinkmann V, Meyer TF. Chlamydia trachomatis remodels stable microtubules to coordinate Golgi stack recruitment to the chlamydial inclusion surface. Mol Microbiol. 2014;94(6):1285–1297. https://doi.org/10.1111/mmi.12829.
- Faris R, Merling M, Andersen SE, Dooley CA, Hackstadt T, Weber MM. Chlamydia trachomatis CT229 subverts Rab GTPase-dependent CCV trafficking pathways to promote chlamydial infection. Cell Rep. 2019;26(12):3380–3390. https://doi.org/10.1016/j.celrep.2019.02.079.
- Ao X, Zou L, Wu Y. Regulation of autophagy by the Rab GTPase network. Cell Death Differ. 2014;21(3):348–358. https://doi.org/10.1038/cdd.2013.187.
- Thomas DR, Newton P, Lau N, Newton HJ. Interfering with autophagy: The opposing strategies deployed by Legionella pneumophila and Coxiella burnetii effector proteins. Front Cell Infect Microbiol. 2020;10:599762. https://doi.org/10.3389/fcimb.2020.599762.
- Dong W, He B, Qian H, Lu Q, Wang D, Li J, Wei Z, Wang Z, Xu Z, Wu G, Qian G, Wang G. RAB26-dependent autophagy protects adherens junctional integrity in acute lung injury. Autophagy. 2018;14(10):1677–1692. https://doi.org/10.1080/15548627.2018.1476811.
- Liu H, Zhou Y, Qiu H, Zhuang R, Han Y, Liu X, Qiu X, Wang Z, Xu L, Tan R, Hong W, Wang T, Rab26 suppresses migration and invasion of breast cancer cells through mediating autophagic degradation of phosphorylated Src. Cell Death Dis. 2021;12(4):284. https://doi.org/10.1038/s41419-021-03561-7.
- Ma Z, Liu K, Zhang R-F, Xie Z-X, Liu W, Deng Y, Li X, Xu B. Manganese-induced α-synuclein overexpression promotes the accumulation of dysfunctional synaptic vesicles and hippocampal synaptotoxicity by suppressing Rab26-dependent autophagy in presynaptic neurons. Sci Total Environ. 2023;858:159753. https://doi.org/10.1016/j.scitotenv.2022.159753.
- Tominello TR, Oliviera ERA, Hussain SS, Elfert A, Wells J, Golden B, Ismail N. Emerging roles of autophagy and inflammasome in ehrlichiosis. Front Immunol. 2019;10:1011. https://doi.org/10.3389/fimmu.2019.01011.
- Lebreton A, Stavru F, Cossart P. Organelle targeting during bacterial infection: insights from Listeria. Trends Cell Biol. 2015;25(6):330–338. https://doi.org/10.1016/j.tcb.2015.01.003.
- Huang J, Brumell JH. Bacteria–autophagy interplay: A battle for survival. Nat Rev Microbiol. 2014;12(2):101–114. https://doi.org/10.1038/nrmicro3160.
- Charro N, Mota LJ. Approaches targeting the type III secretion system to treat or prevent bacterial infections. Expert Opin Drug Discov. 2015;10(4):373–387. https://doi.org/10.1517/17460441.2015.1019860.
- Hotinger JA, Morris ST, May AE. The case against antibiotics and for anti-virulence therapeutics. Microorganisms. 2021;9(10):2049. https://doi.org/10.3390/microorganisms9102049.
- Hu X, Yu J, Zhou X, Li Z, Xia Y, Luo Z, Wu Y. A small GTPase‑like protein fragment of Mycoplasma promotes tumor cell migration and proliferation in vitro via interaction with Rac1 and Stat3. Mol Med Rep. 2014;9(1):173–179. https://doi.org/10.3892/mmr.2013.1766.
- Nicolson GL. Pathogenic Mycoplasma infections in chronic illnesses: General considerations in selecting conventional and integrative treatments. Int J Clin Med. 2019;10(10):477–522.
関連商品
活性型低分子量Gタンパク質 プルダウンアッセイ Biochem Kit™
Cytoskeleton(サイトスケルトン)社 CYTOSKELETON NEWS
※コスモ・バイオのホームページ上にあるCYTOSKELETON NEWSの特集ページです。
掲載元:Cytoskeleton News 2023年4月号


