フォトケージ(Photocage;光感受性保護基)とは、定められた波長の光を照射すると保護基が除去され、元の「活性」状態に戻るもののことを表します。
Cosmo Bio would like to acknowledge and thank the Iris Biotech for providing “Activity Control by Photocaging” information presented here.

はじめに
フォトケージとは感光性基(photoremovable protecting group, PPG) を持つ物質の一種で、決められた波長の光照射(photocleavage) によって除去されるまで、化合物を不活性 (caged)状態に保ちます。外部トリガーとしての光は非侵襲性・高い時空間分解能・投与量コントロールの容易さなど、様々な理由で優れています。
フォトケージは、例えば、固相ペプチド合成の際に酸/塩基に不安定な保護基(protecting groups,PGs)とは別の次元の直交性を導入する目的で使用することができます。さらにPPGはある薬物分子の生物学的活性に関連する官能基を一時的にマスクしたり、あるタンパク間相互作用を抑制したりすることができます。フォトケージされた薬物に関しては、薬理活性を希望するの作用点に適時に選択的に誘導することができ、望ましくないオフターゲット効果のリスクを低減することもできます。
“ケージ(Cage) “の概念は、1978年にHoffmannらが初めて紹介され、感光基としてO-ニトロベンジル部分を持つケージされたATPを合成しました。
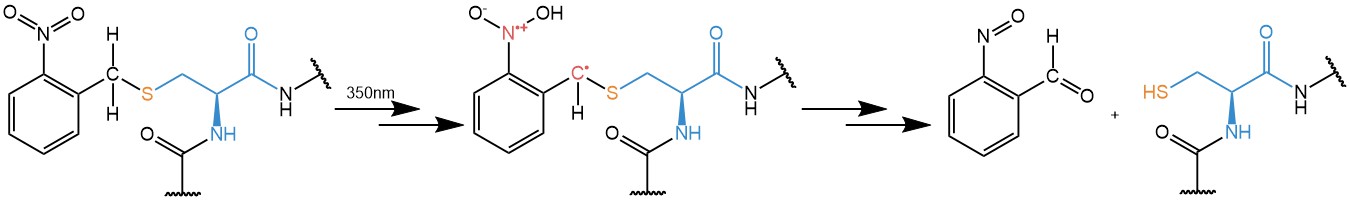
O-ニトロベンジル残基(およびその誘導体)は約350nmの紫外線を吸収します。光子を吸収するとジラジカルが形成され、この基はノルリッシュII型反応を起こし、N=O基の活性化酸素がベンジル位からプロトンを取り出し、転位では、ニトロベンジル残基(保護された官能基が結合している場所)間の結合が切断され、官能基が遊離しo-ニトロソベンズアルデヒドが形成されます。この保護/脱保護スキームはアミノ酸に存在する多くの官能基に対してうまく機能します。
光分解時間を短縮して収率を向上させるために、o-ニトロベラトリル(Nve, oNV, also named 4,5-dimethoxy-2-nitrobenzyl [DMNB]))およびニトロジベンゾフラニル(NDBF)残基を導入することにより、元のニトロベンジル保護が改良されました。
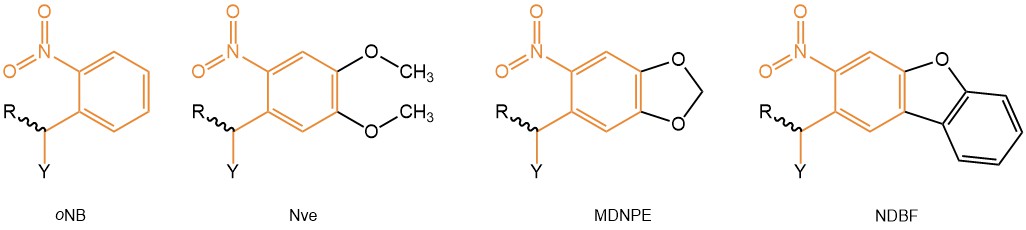
芳香族系を拡大することでより長い波長で光分解を引き起こすことが可能になり、浸透深度が向上し、細胞損傷も減少したので、細胞や生物におけるin vitroおよびin vivoのアプリケーションに使用することができるようになりました。ニトロジベンゾフラン(NDBF)は非常に高い量子収率なため、NDBFでケージされた化合物はニトロベンゾイル残基で保護された化合物よりも16-160倍効率的に光分解されます。そのため800nmの赤外光で2光子励起することでアクセス可能になります。
| oNB | DMNB/Nve/oNV | MDNPE | NDBF | |
| Lysine | FAA9345 FAA9365 | FAA8425 | ||
| Cysteine | HAA9320 FAA3970 | HAA9270 FAA7945 | FAA8420 | |
| Selenocysteine | HAA9475 | HAA9255 | HAA9360 HAA9230 | |
| Glutamate | FAA9350 |
しかし、既存のフォトケージは紫外~可視光域の励起に集中しており「光線治療ウィンドウ」(650~900nm)波長内の深赤色光や近赤外光については、わずかな例しかありません。
合成目的の一例として、S-ピリジンスルフェニル(Npys)システイン(FAA1975)と光ケージされたo-ニトロベラトリル(oNV-)システイン(FAA3970)を組み合わせると、光誘起による迅速な-SS-結合形成を可能にします。例えば、ヨウ素(I2)による酸化で活性化されるアセトアミドメチル(Acm-)システイン(FAA8255)などとともに、直交保護されたシステイン対を段階的に活性化することにより、複数のジスルフィド結合をもつ環状ペプチドを容易に合成することができるようになります。
セレノシステイン(Sec)は、セレノールの方がチオールよりも反応性が高いため、ネイティブなシステインが存在する場合でも、部位特異的な共有結合によるタンパク質修飾を可能にします。変異型ピロリシルtRNA/tRNA合成酵素ペアを用いたアンバーコドンに応答して、光ケージされたセレノシステインは非天然アミノ酸としてタンパク質に取り込まれる可能性があります。光活性化グルタミン酸は、遺伝子コード拡張によりGFP(Green Fluorescent Protein)に組み込まれました。
”シングル “フォトケージ以外にも、生体分子の活性を選択的に制御・追跡し、細胞システムのダイナミクスをプローブするためのデュアル感光性グループに関する文献が報告されています。しかし、このような二重システムは独立した選択的な制御を可能にするために、吸収スペクトルが重ならない必要があります。
■参考文献
- Photolabile Linkers for Solid-Phase Synthesis; R. Mikkelsen, K. Grier, K. Mortensen, T. Nielsen, K. Qvortrup; ACS Comb. Sci. 2018, 20(7): 377–399. https://doi.org/10.1021/acscombsci.8b00028
- Constructing Photoactivatable Protein with Genetically Encoded Photocaged Glutamic Acid; X. Yang, L. Zhao, Y. Wang, Y. Ji, X.-C. Su, J.-A. Ma, W. Xuan; Angew. Chem. Int. Ed. 2023; 62(40): e202308472. https://doi.org/10.1002/anie.202308472
- External-Radiation-Induced Local Hydroxylation Enables Remote Release of Functional Molecules in Tumors; Q. Fu, H. Li, D. Diam, C. Wang, S. Shen, H. Ma, Z. Liu; Angew. Chem. Int. Ed. 2020; 59(48): 21546-21552. https://doi.org/10.1002/anie.202005612
- Synthesis of caged peptides using caged lysine: Application to the synthesis of caged AIP, a highly specific inhibitor of calmodulin-dependent protein kinase II; Y. Tatsu, Y. Shigeri, A. Ishida, I. Kameshita, H. Fujisawa; N. Yumoto; Bioorg. Med. Chem. Lett. 1999; 9(8): 1093-1096. https://doi.org/10.1016/S0960-894X(99)00140-7
- A Facile System for Encoding Unnatural Amino Acids in Mammalian Cells; P. R. Chen, D. Groff, J. Guo, W. Ou, S. Cellitti, B. H. Geierstanger, P. G. Schultz; Angew. Chem. Int. Ed. 2009; 48(22): 4052-4055. https://doi.org/10.1002/anie.200900683
- Site-Specific Engineering of Chemical Functionalities on the Surface of Live Hepatitis D Virus; S. Lin, H. Yan, L. Li, M. Yang, B. Peng, S. Chen, W. Li, P. R. Chen; Angew. Chem. Int. Ed. 2013; 52(52): 13970-13974. https://doi.org/10.1002/anie.201305787
- Mechanism-Based Design of a Photoactivatable Firefly Luciferase; J. Zhao, S. Lin, Y. Huang, J. Zhao, P. R. Chen; J. Am. Chem. Soc. 2013; 135(20): 7410-7413. https://doi.org/10.1021/ja4013535
- Spatiotemporal functional assembly of split protein pairs through a light-activated SpyLigation; E. R. Ruskowitz, B. G. Munoz-Robles, A. C. Strange, C. H. Butcher, S. Kurniawan, J. R. Filteau, C. A. DeForest; Nature Chem. 2023; 15: 694-704. https://doi.org/10.1038/s41557-023-01152-x
- Evaluation of the Kinetics of β-Elimination Reactions of Selenocysteine Se-Conjugates in Human Renal Cytosol: Possible Implications for the Use as Kidney Selective Prodrugs; M. Rooseboom, N. P. E. Vermeulen, I. Andreadou, J. N. Commandeur; J. Pharmacol. Exp. Ther. 2000; 294(2): 762-769. https://jpet.aspetjournals.org/content/294/2/762
- Tissue distribution of cytosolic β-elimination reactions of selenocysteine Se-conjugates in rat and human; M. Rooseboom, N. P. E. Vermeulen, E. J. Groot, J. N. M. Commandeur; Chem.-Biol. Interact. 2002; 140(3): 243-264. https://doi.org/10.1016/S0009-2797(02)00039-X
- A method for directed evolution and functional cloning of enzymes; H. Pedersen, S. Hölder, D. P. Sutherlin, U. Schwitter, D. S. King, P. G. Schultz; PNAS 1998; 95(18): 10523-10528. https://doi.org/10.1073/pnas.95.18.10523
- Light Activation of Protein Splicing with a Photocaged Fast Intein; W. Ren, A. Ji. H.-W. Ai; J. Am. Chem. Soc. 2015; 137(6): 2155-2158. https://doi.org/10.1021/ja508597d
- Light-Activation of DNA-Methyltransferases; J. Wolffgramm, B. Buchmuller, S. Palei, A. Muñoz-López, J. Kanne, P. Janning, M. R. Schweiger, D. Summerer; Angew. Chem. Int. Ed. 2021; 60(24): 13507-13512. https://doi.org/10.1002/anie.202103945
- Biosynthetic selenoproteins with genetically-encoded photocaged selenocysteines; R. Rakauskaitė, G. Urbanavičiūtė, A. Rukšėnaitė, Z. Liutkevičiūtė, R. Juškėnas, V. Masevičius, S. Klimašauskas; Chem. Commun. 2015; 51: 8245-8248. https://doi.org/10.1039/C4CC07910H
- Site-Specific Incorporation of Selenocysteine by Genetic Encoding as a Photocaged Unnatural Amino Acid; A. P. Welegedara, L. A. Adams, T. Huber, B. Graham, G. Otting; Bioconjugate Chem. 2018; 29(7): 2257-2264. https://doi.org/10.1021/acs.bioconjchem.8b00254.
- Genetic Encoding of Photocaged Cysteine Allows Photoactivation of TEV Protease in Live Mammalian Cells; D. P. Nguyen, M. Mahesh, S. J. Elsässer, S. M. Hancock, C. Uttamapinant, J. W. Chin; J. Am. Chem. Soc. 2014; 136(6): 2240-2243. https://doi.org/10.1021/ja412191m.
- Spatio-Temporal Photoactivation of Cytotoxic Proteins; R. Cruz-Samperio, R. J. Mart, L. Y. P. Luk, Y.-H. Tsai, A. T. Jones, R. K. Allemann; ChemBioChem 2022; 23: e202200115. https://doi.org/10.1002/cbic.202200115
- Recent progress in studies of photocages; Y. Li, M. Wang, F. Wang, S. Lu, X. Chen; Smart Molecules 2023; 1(1): e20220003. https://doi.org/10.1002/smo.20220003
- Photo-controllable biochemistry: Exploiting the photocages in phototherapeutic window; H. Xiong, Y. Xu, B. Kim, H. Rha, B. Zhang, M. Li, G.-F. Yang, J. Seung Kim; Chem 2023; 9(1): 29-64. https://doi.org/10.1016/j.chempr.2022.11.007
- Rapid photolytic release of adenosine 5′-triphosphate from a protected analog: utilization by the sodium:potassium pump of human red blood cell ghosts; J. H. Kaplan, B. Forbush III, J. F. Hoffman; Biochemistry 1978, 17(10): 1929–1935. https://doi.org/10.1021/bi00603a020
掲載元:IRIS Biotech社 blog ; “Power On” – Activity Control by Photocaging


