田村 康 先生
山形大学理学部理学科 教授
1978年群馬県生まれ.2002年名古屋大学理学部化学科卒業.07年同大学大学院理学研究科物質理学専攻博士後期課程修了.07年ジョンズホプキンス大学医学部博士研究員.12年名古屋大学高等研究院助教.13年同大学物質科学国際研究センター准教授.15年山形大学理学部物質生命化学科准教授.2019年12月より現職

はじめに
近年,細胞生物学の分野において,メンブレンコンタクトサイト(以下,MCSと表記)と呼ばれる,異なる生体膜(細胞膜やオルガネラ膜)が近接する領域の機能に注目が集まっている。従来,オルガネラは空間的に独立して存在し,それぞれが自律的に機能すると考えられてきた。しかし,実際には異なるオルガネラが MCS を介して物質や情報を交換し,連携して働くことが明らかとなり,MCS の視点からオルガネラ機能を再評価する動きが生まれている。 MCSの形成に関与する主要因子の中に神経変性疾患の原因遺伝子として知られているものが複数含まれており,MCS研究は細胞生物学の枠を超えて,神経科学,病態生理学,創薬研究といった分野においても関心が高まっている。 本稿では,まずMCSの定義を明確にし,近年明らかになってきたMCSの細胞機能について概説する。加えて,今後のMCS研究の展望についても考察したい。
MCSの定義 -メンブレンコンタクトサイトとは?-
MCSとは,一般に異なる生体膜同士が数十ナノメートルの距離で近接している領域を指し,膜間距離は通常30 nm前後とされることが多い。ただし,MCSの膜間距離に明確な基準はなく,なかには約300 nmの距離をとるMCSも報告されている1。単に膜が物理的に近接しているだけではMCSとは見なされず,タンパク質–タンパク質間あるいはタンパク質–脂質間の相互作用によって膜同士が係留されている領域がMCSである(図1)。
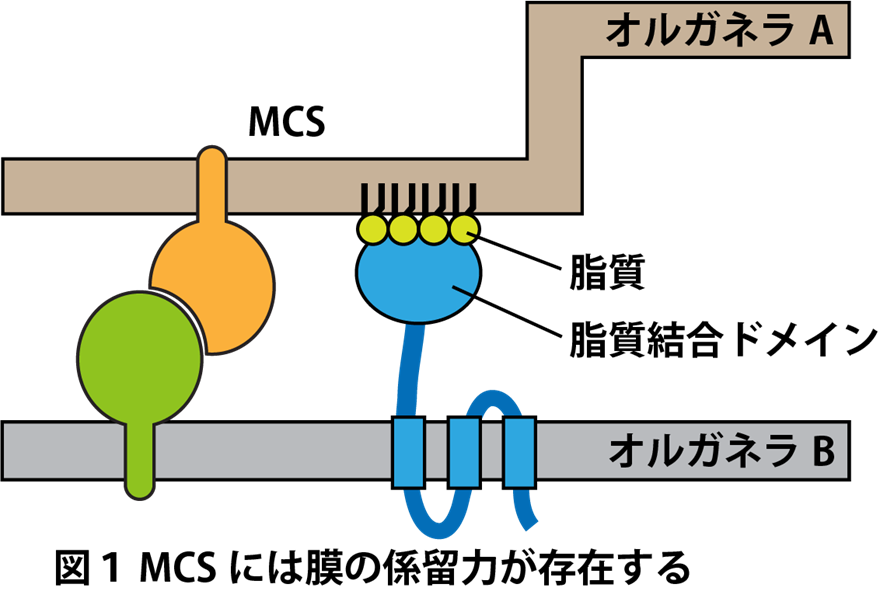
膜融合の過程で一時的に膜が近接・係留されるが,そうした一過性の膜融合中間体はMCSには含まれない。MCSは単なる構造的な接触にとどまらず,生体膜が近接するからこそ効率的に実行できる生理機能を担う場として機能する。MCSは特定のオルガネラ間に限定されず,程度の差はあるものの,おそらくすべてのオルガネラ膜間に形成され,その機能も多様であると考えられる。代表的な機能としては,異なる膜間におけるイオンや脂質などの輸送があげられる2。また,特定の酵素が局所的に濃縮されることで,空間的に制御された酵素反応が行われることもある3,4。さらに,オルガネラの配置や分裂といったオルガネラ膜構造の維持にも重要な役割を果たすことが明らかにされている5。
MCSの形成因子(膜係留因子)
異なる生体膜間を係留するタンパク質は通常,膜貫通ドメインやパルミトイル化などの脂質修飾部位を介して膜に固定され,他方の膜上のタンパク質または脂質と相互作用することでMCSを形成する。以下にMCS形成因子の具体例を紹介する。
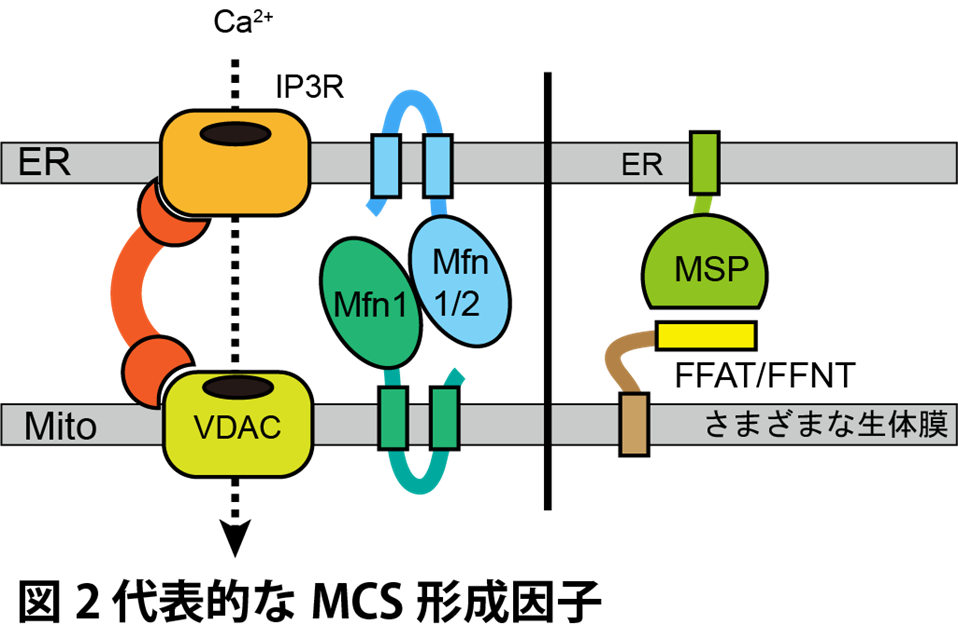
Mfn1,Mfn2は哺乳動物において最も研究されているミトコンドリア-小胞体(ER)間MCS(MCSER-Mito)形成因子である。Mfn1/2はもともとミトコンドリア外膜に局在し,ミトコンドリア融合に関与するGTPaseタンパク質として知られていた。しかし, Mfn2がER膜にも局在する性質を持つことが示され,ER上のMfn2とミトコンドリア外膜上のMfn2のホモティピックな相互作用,あるいは,ER上のMfn2とミトコンドリア上のMfn1とのヘテロティピックな相互作用によりMCSER-Mitoが形成されると考えられている6。Mfn2の欠損によってMCSER-Mitoの形成が減弱し,これに伴いERからミトコンドリアへのCa2+輸送が阻害されることが報告されている6(図2)。
別の代表的なMCS形成因子として,VAP(vesicle-associated membrane protein-associated protein)ファミリータンパク質が知られる。VAPタンパク質はテイルアンカー型のER膜タンパク質であり,そのN末端にはMSPドメインを有する。MSPドメインは,複数の脂質輸送タンパク質に共通して存在するFFAT(two phenylalanines in an acidic tract)やFFNT(two phenylalanines in a neutral tract)モチーフと結合する性質を持つ。FFATモチーフを有するタンパク質はさまざまなオルガネラ膜上に局在しており,VAPタンパク質との相互作用を介して,複数のオルガネラ間でのMCS形成に寄与している7,8(図2)。
VAPタンパク質以外にもCa2+輸送を担うIP3RやVDACなど,多様なMCS形成因子が同定されており,特定のオルガネラ間MCSには複数の膜係留因子が共存することが明らかとなっている。すなわち,MCSは一過的に形成される構造ではなく,複数のオルガネラ係留因子によって安定的に維持される膜構造であると考えられる。実際,特定のMCS形成因子を欠失させても,そのMCS構造が完全に消失することは稀である。たとえば,出芽酵母におけるER–細胞膜(PM)間MCS(MCSER-PM)では,Ist2,Tcb1/2/3,Scs2,Scs22の6つの膜係留因子を同時に欠失させて初めて,MCSの顕著な減少が観察される9。
MCS局在タンパク質の機能
MCSに局在するタンパク質のうち,純粋に生体膜の係留のみを担うものは少なく,ほとんどのタンパク質は何らかの生理機能を併せ持っている。これまでに明らかにされているMCSの代表的な機能としては,脂質やイオンの膜間輸送が挙げられる。特に脂質輸送機構の研究は,MCSの発見を契機として大きく進展した。言い換えれば,MCSが注目される以前は,疎水性の脂質分子が水溶性のサイトゾルを介して異なる膜間をどのように移動するのか,その仕組みは小胞輸送経路以外ではほとんど明らかになっていなかった。 以下では,MCSで働く代表的な脂質輸送タンパク質について紹介する。
1. SMPドメインをもつ脂質輸送タンパク質
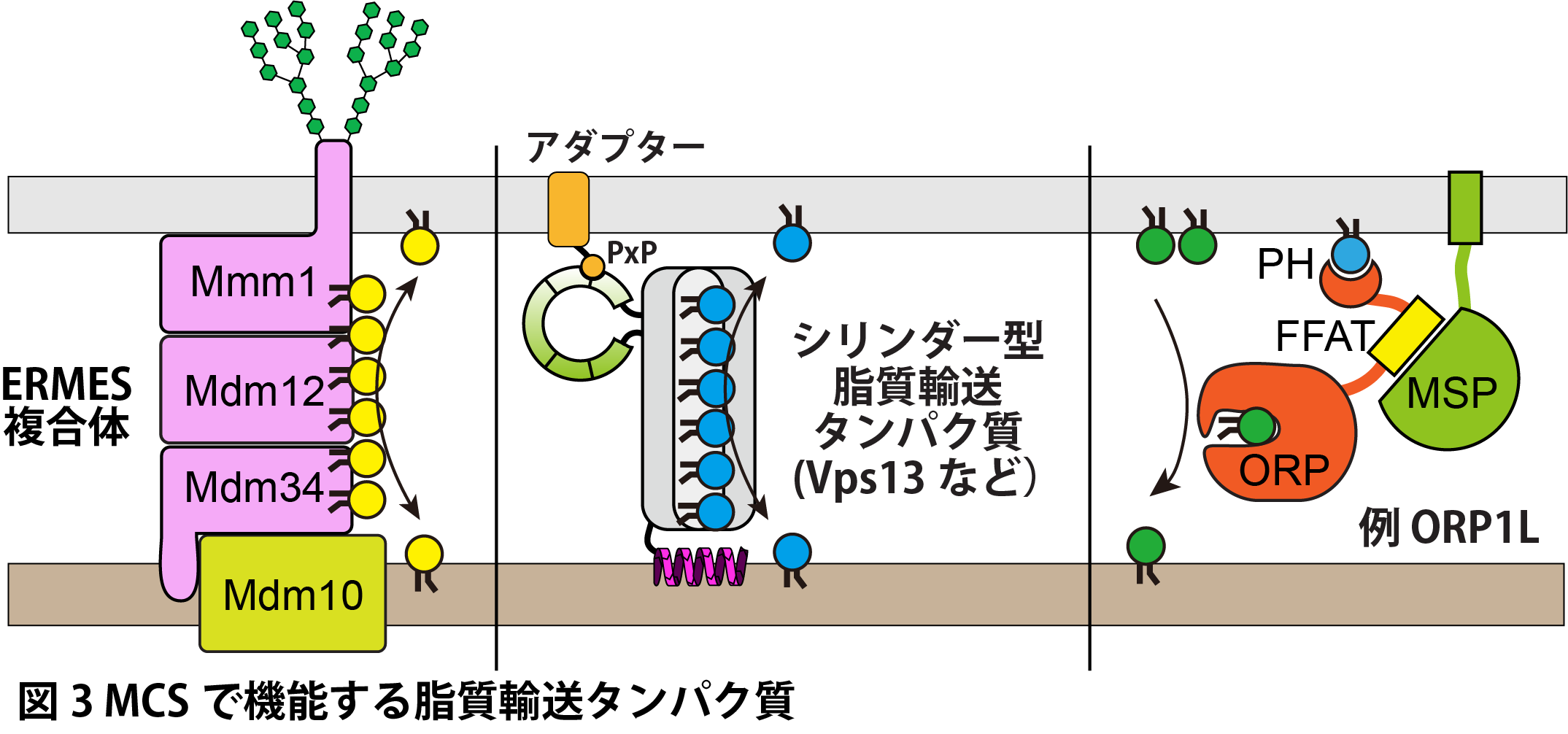
出芽酵母のMCSER-Mitoは,ER膜タンパク質Mmm1,ミトコンドリア外膜タンパク質Mdm10およびMdm34,そしてサイトゾルタンパク質Mdm12から構成されるERMES(ER–mitochondria encounter structure)複合体によって形成される10(図3)。4つのコアサブユニットのうち,Mmm1,Mdm12,Mdm34は脂質輸送に関与するSMPドメインを持ち,実際にこれらのオルガネラ膜間でのリン脂質輸送を仲介することが知られている11。同様のSMPドメインは,出芽酵母のER–PM間のテザリング因子Tricalbins(Tcb1〜3)や9,核膜–液胞間MCS(NVJ, Nucleus-Vacuole Junction)に局在するNvj2にも存在し12,これらの膜間での脂質輸送を担うと考えられている。 哺乳類においても,SMPドメインを有するER膜タンパク質PDZD8が,ミトコンドリア上のFKBP8と相互作用することでER–ミトコンドリア間MCSを,エンドソーム上のRab7と相互作用することでER–エンドリソソーム間MCSを形成し,脂質輸送を担うことが報告されている13–16。
2. シリンダー型脂質輸送タンパク質
生体膜を橋渡しするシリンダー型の脂質輸送因子として,Vps13ファミリーが知られている(図3)。Vps13は,ERMES複合体の機能不全により生じる細胞増殖阻害を回復させる復帰突然変異酵母株の解析から同定された17。このタンパク質は,ミトコンドリア,エンドソーム,液胞膜に局在するPxPドメインを有するアダプタータンパク質と相互作用することで,ERと各オルガネラとの間のMCSで機能することが知られる18。酵母ではVps13と同様のシリンダー型巨大脂質輸送タンパク質としてFmp27, Hob2, Csf1, Atg2が知られており,これらの因子もさまざまなMCSにおいて機能することが報告されている19。
VPS13は酵母からヒトまで保存されおり,Vps13AとVps13CがそれぞれER-ミトコンドリア間やER-エンドソーム,ER-脂肪滴間MCSに局在し,これらの膜間で脂質輸送を仲介することが報告されている20。さらにVps13Dはミトコンドリアとペルオキシソーム上に局在するMiroと相互作用することで,ER膜からこれらのオルガネラへ脂質を輸送することが報告されている21。
3. その他の脂質輸送タンパク質
上記以外にもMCSで機能する脂質輸送因子は他にも多数発見されている。前述のVAPタンパク質は,エンドソームやリソソーム膜上のSTARD3およびORP1L,ゴルジ体上のSTARD11およびCERT,ミトコンドリア上のPTPIP51といったFFATモチーフを持つ脂質輸送タンパク質と相互作用することで,ERとこれらのオルガネラ膜との間にMCSを形成し,脂質輸送を仲介する8。STARD3, STARD11, CERTはsteroidogenic acute regulatory protein (StAR)-related lipid transfer (START) ドメインを有するタンパク質で,植物および動物で保存された脂質輸送タンパク質である22。またORP1Lは,Oxysterol-binding protein (OSBP)-related proteins(ORP)ファミリーに属する脂質輸送タンパク質であり,酵母からヒトに至るまで高度に保存されている。ORPファミリータンパク質の多くは,FFATモチーフに加え,ホスホイノシチドと結合するPH(Pleckstrin Homology)ドメインを有しており,これらのドメインを介して膜間の結合と脂質の輸送を担っている23,24(図3)。PTPIP51はこれまでにない新しいタイプの脂質輸送タンパク質で一般的にタンパク質間相互作用に関与する構造として知られていたTPRモチーフが脂質輸送活性を持つことが示された25。このような多数の脂質輸送因子が関与する細胞内脂質交通ネットワークに関する知見は,この十数年で飛躍的に発展した。
MCSの動的な性質
MCSが特有の生理機能を担うという事実は,これらの機能が多様な生理的条件に応じて調節されうることを示す。私たちは近年,栄養状態やストレス環境に応じて構造および機能が動的に変化するMCSに着目し,MCSを介した細胞ストレス応答機構の解明に取り組んできた。以下に,最近明らかとなったMCSと細胞ストレス応答の具体例を紹介する。

過去の研究により,ERストレス条件下ではリン脂質合成が活性化され,それに伴うER膜の拡張がERストレス軽減に寄与することが報告されていた26。しかし,単にリン脂質合成が亢進しても,それらがER外へ輸送されてしまえば,ER膜だけを選択的に拡張することはできない。私たちは,ERストレス時に細胞内の脂質輸送が調節されていると考え,ERMES複合体の機能に着目して解析を行った。その結果,ERストレス下ではERMES複合体が解離し(図4),ERからミトコンドリアへのリン脂質輸送が抑制されることを明らかにした27。すなわち,脂質輸送の抑制によりER膜の拡張が促進され,それがERストレスの軽減に寄与していると考えられる。
また,酵母の核膜–液胞間MCSであるNVJは,窒素飢餓やグルコース飢餓条件下で顕著に拡大することが知られていたが,その分子機構や生理的意義は長らく不明であった(図4)。私たちは最近,MCS領域に局在するタンパク質を空間的に特異的にビオチン標識することで網羅的に同定可能な実験手法「CsFiND(Complementation assay using fusion of split-GFP and TurboID)」を開発し28,グルコース飢餓時にNVJに集積する新規因子を複数同定した。これらの因子を解析した結果,グルコース飢餓条件下ではNVJの膜環境が変化し,その変化を感知するセンサータンパク質がさまざまな因子をNVJに集積させることで,NVJ領域におけるエルゴステロール合成を調節していることが明らかとなった29。これらの知見は,MCSが単なる物質輸送の場にとどまらず,ストレス応答のプラットフォームとして機能することを示すものである。
このようなMCSの動的制御は,出芽酵母に限らず哺乳類細胞においても観察されている。酸化ストレス下では,ミトコンドリア外膜タンパク質PTPIP51に存在するFFAT-likeモチーフ(FFATのA(酸性アミノ酸)がセリン/スレオニンに置換されているFFAT様配列30)がリン酸化され,ER–ミトコンドリア間MCSの形成が促進される。これにより,ミトコンドリアで生じた過酸化脂質がERに輸送され,脂質ラジカルによる毒性が軽減されて細胞死が抑制されることが示された31。この結果もまた,MCSER-Mito が細胞ストレス応答に関与することを示す好例である。
MCS研究の展望
MCSは,ここ十数年で研究が急速に進展してきた新たな細胞内構造であり,依然として多くの未解決問題が残されている。今後,MCSに局在する新規因子やMCSの新規機能の発見に加え,細胞ストレスや外部環境の変化に応じたMCSの動的制御機構の解明が進むと期待される。これらの研究を推進するためには,MCSに濃縮されるタンパク質成分を明らかにする解析が不可欠である。現在,多数のMCS関連因子が同定,報告されているが,明確なコンセンサスのあるMCS局在因子はまだ限られている。またMCS局在因子の構成は細胞種や環境に依存して変化すると考えられる。したがって,より詳細かつ条件依存的なMCSプロテオーム解析が今後の課題となるだろう。
MCSの脂質環境に関しては,現時点でほとんど情報が得られていない。唯一,MCSER–Mitoに関しては,セラミドやステロールに富むラフト様構造をとる可能性が示唆されているが,その実態は未だ十分に解明されていない32。今後は,MCS局所の脂質組成を明らかにするためのリピドミクス解析技術や,生体膜の物性を可視化する新規プローブの開発が,MCSの理解を深めるうえで重要になると考えられる。
MCSが関連する疾患メカニズムの理解もより深まっていくことが期待される。最初に発見されたMCSER–Mito形成因子であるMfn2は,末梢神経障害の一種であるCharcot–Marie–Tooth病の原因遺伝子であり,複数のMCS形成に関与するVAPBは筋萎縮性側索硬化症,VPS13ファミリーはパーキンソン病などの神経変性疾患と関連している。MCSの形成機構およびその生理的意義の解明は,基礎生命科学上の重要課題であると同時に,これらの疾患の病態理解を深めるうえでも極めて重要である。今後,MCSに関する知見の蓄積により,新たな診断マーカーや治療標的の同定が進み,創薬研究への波及効果が期待される。
■参考文献
- Ping, H. A., Kraft, L. M., Chen, W., Nilles, A. E. & Lackner, L. L. Num1 anchors mitochondria to the plasma membrane via two domains with different lipid binding specificities. J. Cell Biol. 213, 513–524 (2016).
- Tamura, Y., Kawano, S. & Endo, T. Organelle contact zones as sites for lipid transfer. J. Biochem. (Tokyo) 165, 115–123 (2019).
- Kohlwein, S. D. et al. Tsc13p Is Required for Fatty Acid Elongation and Localizes to a Novel Structure at the Nuclear-Vacuolar Interface inSaccharomyces cerevisiae. Mol. Cell. Biol. 21, 109–125 (2001).
- Rogers, S., Hariri, H., Wood, N. E., Speer, N. O. & Henne, W. M. Glucose restriction drives spatial reorganization of mevalonate metabolism. eLife 10, e62591 (2021).
- Friedman, J. R. et al. ER Tubules Mark Sites of Mitochondrial Division. Science 334, 358–362 (2011).
- de Brito, O. M. & Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature 456, 605–610 (2008).
- Cabukusta, B. et al. Human VAPome Analysis Reveals MOSPD1 and MOSPD3 as Membrane Contact Site Proteins Interacting with FFAT-Related FFNT Motifs. Cell Rep. 33, 108475 (2020).
- Kors, S., Costello, J. L. & Schrader, M. VAP Proteins – From Organelle Tethers to Pathogenic Host Interactors and Their Role in Neuronal Disease. Front. Cell Dev. Biol. 10, 895856 (2022).
- Manford, A. G., Stefan, C. J., Yuan, H. L., MacGurn, J. A. & Emr, S. D. ER-to-Plasma Membrane Tethering Proteins Regulate Cell Signaling and ER Morphology. Dev. Cell 23, 1129–1140 (2012).
- Kornmann, B. et al. An ER-mitochondria tethering complex revealed by a synthetic biology screen. Science 325, 477–481 (2009).
- Kawano, S. et al. Structure–function insights into direct lipid transfer between membranes by Mmm1–Mdm12 of ERMES. J. Cell Biol. 217, 959–974 (2018).
- Toulmay, A. & Prinz, W. A. A conserved membrane-binding domain targets proteins to organelle contact sites. J Cell Sci 125, 49–58 (2012).
- Hirabayashi, Y. et al. ER-mitochondria tethering by PDZD8 regulates Ca 2+ dynamics in mammalian neurons. Science 358, 623–630 (2017).
- Elbaz-Alon, Y. et al. PDZD8 interacts with Protrudin and Rab7 at ER-late endosome membrane contact sites associated with mitochondria. Nat. Commun. 11, 1–14 (2020).
- Shirane, M. et al. Protrudin and PDZD8 contribute to neuronal integrity by promoting lipid extraction required for endosome maturation. Nat. Commun. 11, 4576 (2020).
- Nakamura, K. et al. Mitochondrial complexity is regulated at ER-mitochondria contact sites via PDZD8-FKBP8 tethering. Nat. Commun. 16, 3401 (2025).
- Lang, A. B., John Peter, A. T., Walter, P. & Kornmann, B. ER-mitochondrial junctions can be bypassed by dominant mutations in the endosomal protein Vps13. J. Cell Biol. 210, 883–890 (2015).
- John Peter, A. T. et al. Vps13-Mcp1 interact at vacuole-mitochondria interfaces and bypass ER-mitochondria contact sites. J. Cell Biol. 216, 3219–3229 (2017).
- Toulmay, A. et al. Vps13-like proteins provide phosphatidylethanolamine for GPI anchor synthesis in the ER. J. Cell Biol. 221, e202111095 (2022).
- Kumar, N. et al. VPS13A and VPS13C are lipid transport proteins differentially localized at ER contact sites. J. Cell Biol. 217, 3625–3639 (2018).
- Guillén-Samander, A. et al. VPS13D bridges the ER to mitochondria and peroxisomes via Miro. J. Cell Biol. 220, (2021).
- Alpy, F. & Tomasetto, C. START ships lipids across interorganelle space. Biochimie 96, 85–95 (2014).
- Nakatsu, F. & Kawasaki, A. Functions of Oxysterol-Binding Proteins at Membrane Contact Sites and Their Control by Phosphoinositide Metabolism. Front. Cell Dev. Biol. 9, 664788 (2021).
- Olkkonen, V. M. & Ikonen, E. Getting to Grips with the Oxysterol-Binding Protein Family – a Forty Year Perspective. Contact 7, 25152564241273598 (2024).
- Yeo, H. K. et al. Phospholipid transfer function of PTPIP51 at mitochondria‐associated ER membranes. EMBO Rep. 22, 1–14 (2021).
- Schuck, S., Prinz, W. A., Thorn, K. S., Voss, C. & Walter, P. Membrane expansion alleviates endoplasmic reticulum stress independently of the unfolded protein response. J. Cell Biol. 187, 525–536 (2009).
- Kakimoto-Takeda, Y. et al. Dissociation of ERMES clusters plays a key role in attenuating the endoplasmic reticulum stress. iScience 25, 105362 (2022).
- Fujimoto, S., Tashiro, S. & Tamura, Y. Complementation Assay Using Fusion of Split-GFP and TurboID (CsFiND) Enables Simultaneous Visualization and Proximity Labeling of Organelle Contact Sites in Yeast. Contact 6, 251525642311536 (2023).
- Fujimoto, S. & Tamura, Y. Glucose Starvation Sensing through Membrane Remodeling at the Nucleus-Vacuole Junction Coordinates Ergosterol Biosynthesis. bioRxiv 2025.05.29.656913 (2025) doi:10.1101/2025.05.29.656913.
- Di Mattia, T. et al. FFAT motif phosphorylation controls formation and lipid transfer function of inter-organelle contacts. EMBO J. 39, e104369 (2020).
- Shiiba, I. et al. ER-mitochondria contacts mediate lipid radical transfer via RMDN3/PTPIP51 phosphorylation to reduce mitochondrial oxidative stress. Nat. Commun. 16, 1508 (2025).
- Garofalo, T. et al. Evidence for the involvement of lipid rafts localized at the ER-mitochondria associated membranes in autophagosome formation. Autophagy 12, 917–935 (2016).
実験医学別冊
疾患研究につながる オルガネラ実験必携プロトコール
各細胞小器官からオルガネラコンタクトまで、
実験法のセオリーと熟練のノウハウ
田村 康,山野晃史/編
出版社:株式会社 羊土社
発行日:2024年11月13日
I S B N :978-4-7581-2275-7
価 格:8,360円(税込)
掲載元:Lab.First 研究ナレッジ

