井上 敬一 先生
神吉 智丈 先生
新潟大学大学院医歯学総合研究科機能制御学分野
はじめに
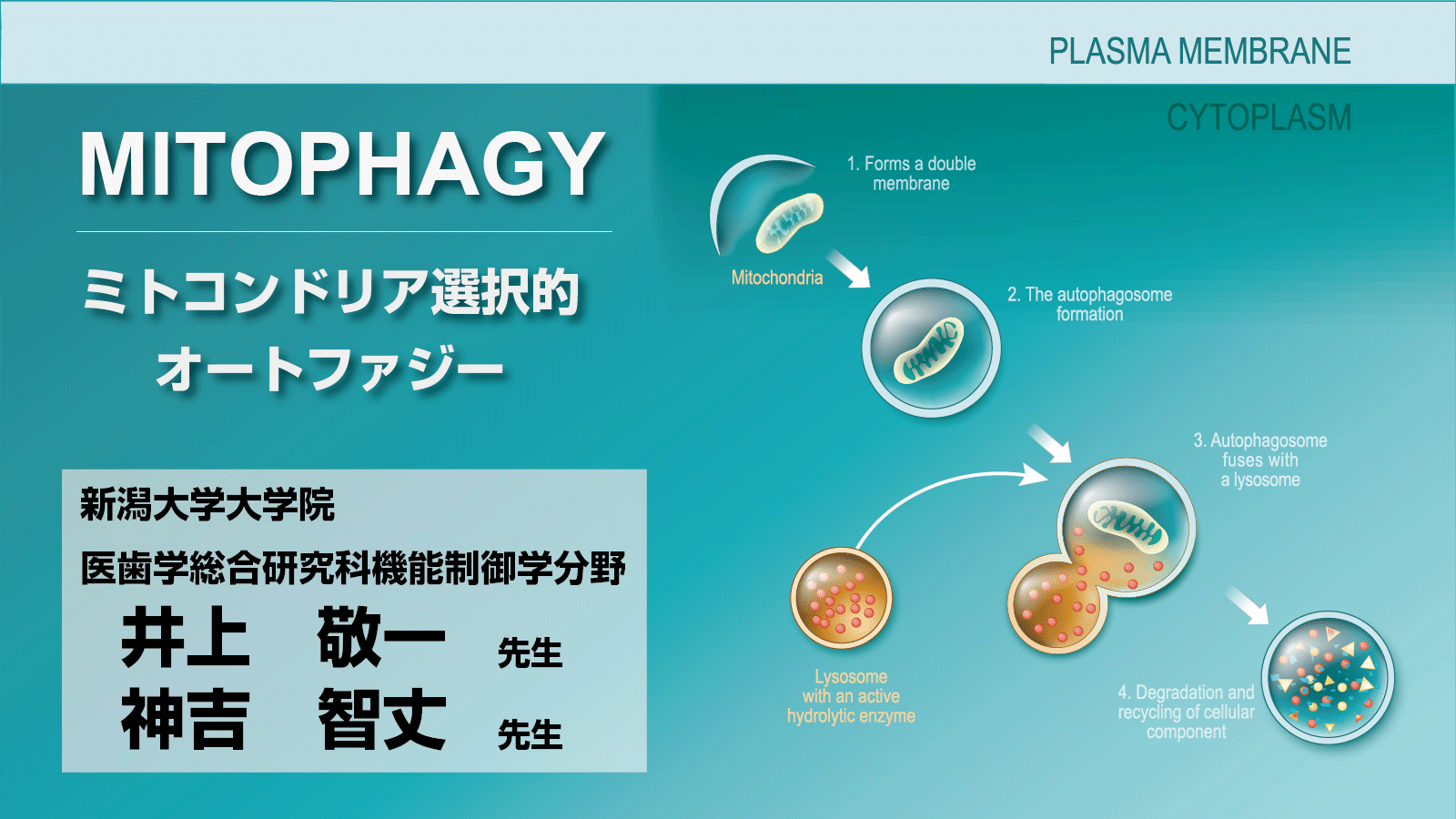
オルガネラのひとつミトコンドリアは、摂取した糖や脂肪などの栄養素から、細胞活動に必須のエネルギー分子であるATP(アデノシン三リン酸)を産生しています。この重要な役割をもつミトコンドリアがどのようにして生成されるのかについては、古くから多くの研究者が注目し、詳細に解明されてきました。一方で、量が多すぎたり、傷ついたりして不要となったミトコンドリアがどのように処理されているかについては不明な点が多く残されていました。近年の研究から、こうしたミトコンドリアはオートファジーによって積極的に分解され、適切なATPを供給できるように調節されていることが判ってきました。このオートファジーによりミトコンドリアを分解する現象は、“マイトファジー(ミトコンドリア選択的オートファジー)”と呼ばれ、現在、多くの研究者により精力的に研究されています
オートファジーとは?
オートファジーは、タンパク質やオルガネラなどの細胞質成分をいったん隔離した後、分解する現象です。このオートファジーは、多くの真核生物で見られ、細胞が生きていくために重要な役割を担っています。例えば、細胞が栄養飢餓状態に陥ると、オートファジーが誘導され、タンパク質やオルガネラを「非選択的」にまとめて分解し、アミノ酸や脂質などが産生されます。この新しくできた栄養素を使って、細胞は飢餓状態で生き延びるために必要なタンパク質を合成し、危機を乗り越えようとします。オートファジーが誘導されると、隔離膜と呼ばれる扁平状の膜小胞が現れ、これが伸長することで、タンパク質やオルガネラなどの細胞質成分を包み込みます(図1A)。完全に包み込んだ脂質二重膜構造はオートファゴソームと呼ばれ、このオートファゴソームがリソソームと融合し、リソソームの加水分解酵素により、オートファゴソームに取り込まれた細胞質成分は分解されます。
このオートファジーは、電子顕微鏡観察などにより1960年代からその存在自体は知られていましたが、その分子機構は不明でした1)。1990 年代、大隅良典先生(現東京工業大)らによる、出芽酵母のオートファジーの実行に必須なATG 遺伝子群の同定を端緒として、その後大きく研究が進展しました2)。現在では、オートファジーの分子機構は詳細に解明されています。
マイトファジーとは?
前述のように、オートファジーは、細胞質成分を「非選択的」に分解する現象として研究されてきました。一方で近年、オートファジーは、ミトコンドリアやペルオキシソーム、小胞体など特定の標的を、それぞれ「選択的」にも分解できることが明らかになってきました。こうしたオートファジーは、選択的オートファジーと呼ばれています。選択的オートファジーの中でも、ミトコンドリアを標的とするものが「マイトファジー」です。
マイトファジー過程の大部分はオートファジーと共通であり、これらの根本的な違いは、「隔離膜が分解標的としてミトコンドリアを選択的に認識するかどうか」にあります(図1)。実際、出芽酵母を用いた実験で、オートファジーの実行に必須のATG 遺伝子の全てがマイトファジーの実行にも必須であること、そして、隔離膜によるミトコンドリア選択的な認識にはマイトファジー特有の遺伝子が必要であること、が確認されています3)。
それでは、隔離膜はどのようにしてミトコンドリアのみを選択的に認識しているのでしょうか?そのメカニズムとして、2 種類の経路が知られています。ひとつはレセプター依存的な経路、もうひとつはユビキチン依存的な経路です。
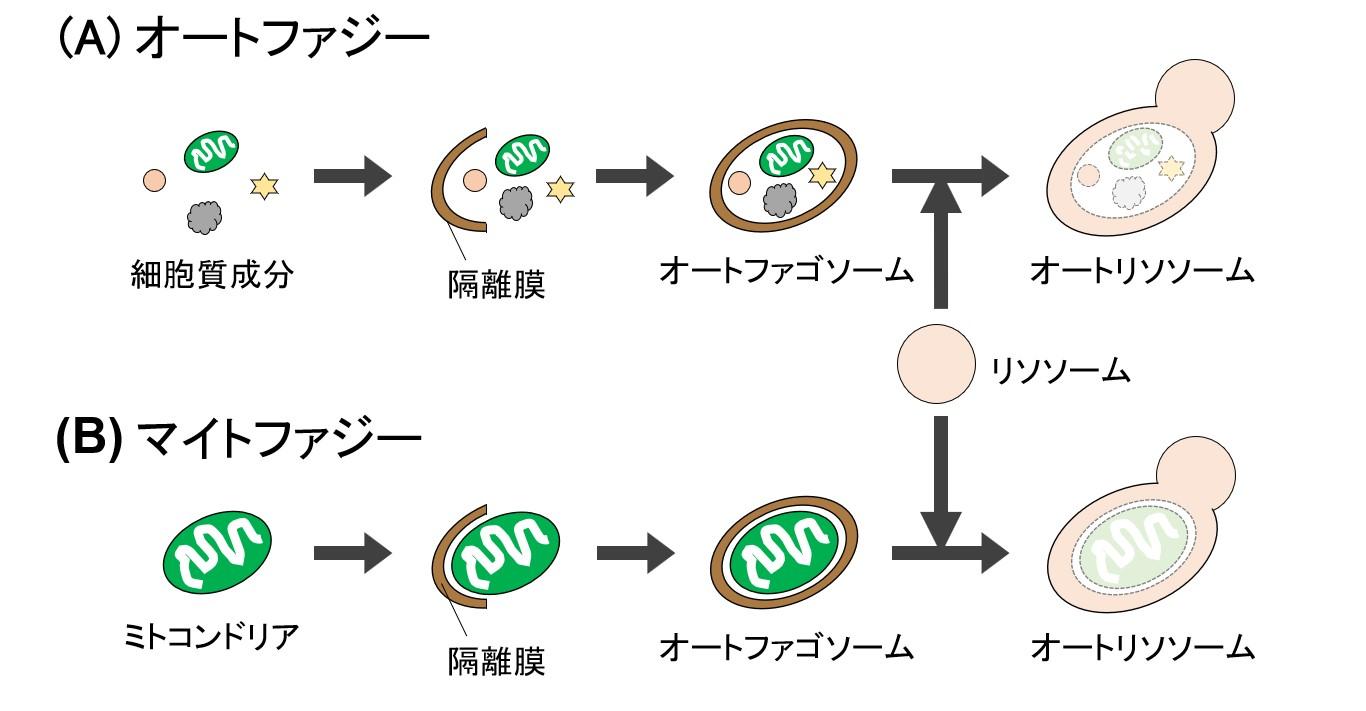
オートファジーとマイトファジーの根本的な違いは、隔離膜がミトコンドリアを選択的に認識するかどうかである。隔離膜の形成から、リソソームでの分解に至る過程は共通であり、いずれもATG遺伝子群が必須である。
レセプター依存的マイトファジー経路
レセプター依存的マイトファジーは、ミトコンドリア外膜に存在するマイトファジーレセプタータンパク質(レセプター)を介した経路です(図2A)。ミトコンドリア外膜に存在するレセプターと隔離膜が結合することで、ミトコンドリアを選択的にオートファゴソーム内に取り込み分解します。これまでレセプターとして、出芽酵母Atg32、分裂酵母Atg43、哺乳類のBNIP3、BNIP3(L NIX)、FUNDC1などが報告されています4)~8)。いずれのレセプターも、N 末端側に隔離膜上の分子と結合する領域、C 末端側に ミトコンドリア外膜に貫通する領域を持ちます。窒素源飢餓や低酸素などマイトファジー誘導条件になると、ミトコンドリア外膜に存在するレセプターが、主にリン酸化により活性化されたのち、隔離膜に認識されることで、ミトコンドリア選択的な分解が開始されます8)~10)。
ユビキチン依存的マイトファジー経路
ユビキチン依存的マイトファジーは、ミトコンドリア外膜に存在するタンパク質のユビキチン化を介した経路です(図2B)。ミトコンドリア外膜に形成されたユビキチン鎖を、隔離膜が認識することで、ミトコンドリアを選択的にオートファゴソーム内に取り込み分解します。この経路の開始には、PINK1やParkinといったパーキンソン病関連因子が関わります11)、12)。ミトコンドリアが損傷を受け膜電位が低下すると、活性化したPINK1がユビキチン化酵素Parkinをミトコンドリア外膜にリクルートし、ミトコンドリア外膜のタンパク質のユビキチン化を開始します。その後、OptineurinやNDP52といったオートファジーアダプタータンパク質がユビキチン鎖と結合し、アダブタータンパク質を介して隔離膜とミトコンドリアがつながることで、ミトコンドリア選択的な分解が開始されます13)。
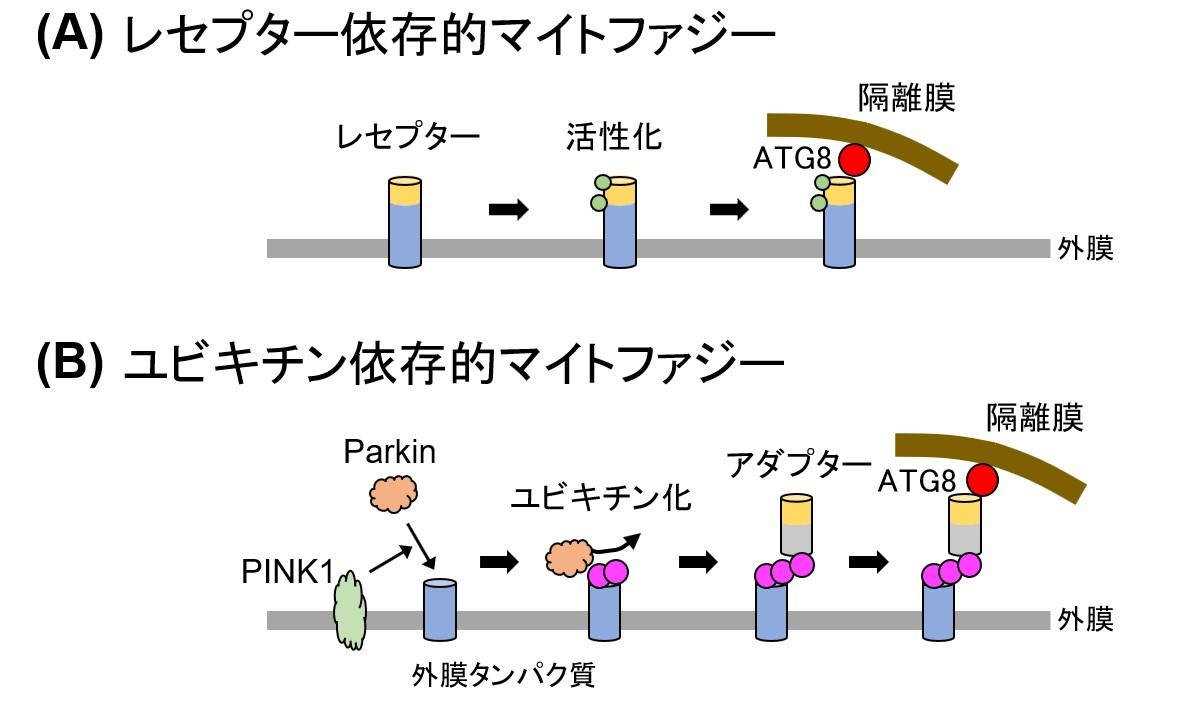
(A) レセプター依存的マイトファジー : ミトコンドリア外膜に存在するレセプターは、隔離膜上のATG8(哺乳類ではLC3ファミリータンパク質)と結合する領域を持つ。リン酸化等でレセプターが活性化されると、レセプターとATG8/LC3が結合し、ミトコンドリアが隔離膜により認識される。
(B) ユビキチン依存的マイトファジー : 活性化されたPINK1によりParkinがミトコンドリアにリクルートされると、Parkinはミトコンドリア外膜タンパク質をユビキチン化する。形成されたユビキチン鎖に、ATG8/LC3との結合領域を持つアダプターが結合し、ミトコンドリアが隔離膜により認識される。
マイトファジーの生理的意義
それでは、マイトファジーは生体内においてどのような機能を果たしているのでしょうか?例えば、ユビキチン依存的マイトファジーに関わるPINK1とParkinはパーキンソン病の原因遺伝子であることから、神経細胞の長期生存におけるマイトファジーの関与が想像されます13)。一方、レセプター依存的マイトファジーに関わるBNIP3L(NIX)遺伝子の欠損マウスは、赤血球の成熟過程におけるミトコンドリアの除去に異常が見られます7)、8)、14)。このように、マイトファジーは様々な生命現象との関わりが示唆されますが、その生理的意義の解明は不十分です。私たちは近年、動物個体レベルでのマイトファジーの生理機能を解明するため、マイトファジーモニターマウスを開発しました15)。その結果、全身の多くの臓器や細胞で定常的にマイトファジーが起こっていることを報告しました。さらに、一時的な絶食や歩行制限により、心筋や骨格筋でマイトファジーが誘導されることも明らかにしました。今後マイトファジーモニターマウスや病態モデルマウスを用いて、マイトファジーの生理的意義を解明していく予定です。
■参考文献
- De Duve C & Wattiaux R. Functions of lysosomes. Ann Rev Physiol. 28:435-492, 1966.
- Takeshige K, Baba M, Tsuboi T, et al. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. J Cell Biol. 119(2):301-311, 1992
- Kanki T, & Klionsky DJ. Mitophagy in yeast occurs through a selective mechanism. J Biol Chem. 283(47):32386-32393, 2008
- Kanki T, Wang K, Cao Y, et al. Atg32 is a mitochondrial protein that confers selectivity during mitophagy. Dev Cell. 17(1):98-109, 2009
- Okamoto K, Kondo-Okamoto N, Ohsumi Y. Mitochondria-anchored receptor Atg32 mediates degradation of mitochondria via selective autophagy. Dev Cell. 17(1):87-97, 2009
- Fukuda T, Ebi Y, Saigusa T, et al. Atg43 tethers isolation membranes to mitochondria to promote starvation-induced mitophagy in fission yeast. eLife.9:e61245, 2020
- Onishi M Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy. EMBO J. 40(3):e104705, 2021.
- Onishi M Yamano K, Sato M, et al. Molecular mechanisms and physiological functions of mitophagy. EMBO J. 40(3):e104705, 2021.
- Kanki T, Kurihara Y, Jin X, et al. Casein kinase 2 is essential for mitophagy. EMBO J. 14(9):788-794, 2013
- Furukawa K, Fukuda T, Yamashita SI, et al. The PP2A-like Protein Phosphatase Ppg1 and the Far Complex Cooperatively Counteract CK2-Mediated Phosphorylation of Atg32 to Inhibit Mitophagy. Cell Rep. 23(12):3579-3590, 2018
- Yamashita SI, Jin X, Furukawa K, et al. Mitochondrial division occurs concurrently with autophagosome formation but independently of Drp1 during mitophagy. J Cell Biol. 215(5):649-665, 2016
- Narendra D, Tanaka A, Suen DF, et al. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183(5):795-803, 2008
- Kitada T, Asakawa S, Hattori N, et al. Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism. Nature. 392(6676):605-608, 1998.
- 井上敬一、神吉智丈 マイトファジーとミトコンドリア病 医学のあゆみ 281(12):1145-50, 2022.
- Yamashita SI, Kyuuma M, Inoue K, et al. Mitophagy reporter mouse analysis reveals increased mitophagy activity in disuse-induced muscle atrophy. J Cell Physiol. 236(11):7612-7624, 2021
掲載元:コスモバイオニュース 199号