吉岡 祐亮 先生
東京医科大学 医学総合研究所 分子細胞治療研究部門

はじめに
筆者は小学生の頃、テレビゲームが好きで、特にRPGを好んでいた。ドラゴンクエストやファイナルファンタジーと言ったゲームには、かなりの時間を費やした。このようなゲームの中で必ずと言っていいほど、出てくるものが宝箱だ。中には貴重なアイテムやストーリーの進行に欠かせないものが入っていたりする場合もあって、宝箱を見つけるとワクワクした記憶がある。しかし、鍵が掛かっている宝箱も度々あり、開けられない時はどうしたものかと悩んだ。ストーリーの後半に手にいれる鍵もあれば、近くの敵を倒せば手に入る時など様々だが、鍵が掛かっている=重要なアイテムが入っている、という認識で、どうしてもその宝箱が気になってしまうのだ。
そのうち、中学生、高校生となるに連れ、あれだけやっていたゲームをしなくなり、気がつけば、大学院生となっていたのだが、そこでまたしても、鍵が掛かった宝箱(と思われるもの)に出会った。それが、エクソソームだ。もちろん、宝箱も鍵も“比喩”であり、エクソソームには鍵も掛かっていないし、宝箱のように何か冒険に必要なアイテムが入っているわけではない。しかし、エクソソームの中には、様々な分子が詰め込まれており、それらを上手く使いこなすこと(=鍵を使って開けること)で、宝箱のような存在になりうるのだ。人々がエクソソームという宝箱に気づいてから、かなり時間が経っており、現状、この宝箱を開けることができたのか、そして、私たちとエクソソームの関わりが将来どのようになっていくのかを考え、概説する。
エクソソームは分子の複合体
エクソソームを始めとする細胞外小胞は、かなりバラエティに富んでいる。“バラエティ”という単語は便利であり、何となく多様性があり複雑な、何でもありな感じがしてしまう。ここで言うバラエティとは、細胞外小胞を構成する分子の多様性を指す。エクソソームの定義を思い返してみると、細胞がエンドソームを経由して分泌する脂質二重膜を有する小胞である[1]。つまり、分泌する細胞の種類や特定の分子の有無については言及されていない。なぜなら、様々な細胞が小胞を分泌するし、それらの構成分子は多岐に渡り、タンパク質、mRNAやmiRNAなどの核酸、脂質、代謝産物などカテゴリーの異なる分子群が含まれており[1]、特定の分子で定義することが難しいからである。それは他の細胞外小胞でも同じことが言える。これら分子がいくつもの組み合わせでエクソソームに含まれることから、エクソソームはバラエティに富んでいると言える[2]。このような多種多様な細胞外小胞が細胞間コミュニケーションツールとして働くことは、多彩な生命現象を制御している一因であろう。例えば、細胞間情報伝達物質として、サイトカインなどが有名であるが、これらは主に1つのタンパク質を用いて特定のレセプターを発現している細胞へと伝達する様式であり、免疫系や造血系の細胞でのやりとりが多い。サイトカインの種類自体は多いものの、バラエティに富んでいると言うよりは、微量で特異的な細胞に対して生理作用を示し、一対一対応のような一様な存在と感じる。話を戻すと、エクソソームはサイトカインのような、ハッキリとした存在ではなく、分子から規定するのが難しい存在である。
また、エクソソームの構成分子は、由来する細胞や細胞が置かれている状況によって異なることが示されており、構成分子のバラエティを生み出している要因の一つとなっている[2]。それと同時に、細胞は自身のアイデンティティや状況を伝えるメッセージを分子として、エクソソームに詰め込んで分泌している。つまり、エクソソームの構成分子を覗き見ることで、どのような細胞が、どのような状況で、何のために分泌したか分かるかもしれない。実は、このことがエクソソームを宝箱と思える理由に繋がっている。例えば、エクソソームの構成分子を解析することで、分泌した細胞を特定し、その細胞の状況を把握した時、それが、がん細胞のもので、まさに転移しようとする状況ということを知れたら、エクソソームは宝箱となりうるのではないだろうか。
エクソソームリキッドバイオプシーの可能性
ゲームにおいて、誰がどのような理由で宝箱を設置したのかは、考えれば考えるほど謎である。ストーリー上、その理由が分かるものもあるのだが、大半は分からないし、敵がわざわざ設置してくれたと考えると何がしたいのか分からない。しかし、前述したようにエクソソームにおいては、中身を見ることで、どのような細胞がどういった理由で分泌したのかが分かる可能性がある。この事を利用したのが、リキッドバイオプシーによる疾患診断である。
細胞外小胞はわれわれの体液中を循環しており、現状の技術では正確な数は算出できないが、Nanoparticle tracking analysisを用いると、血液中では、約~1011個/mL、尿中では約~1010個/mL、とかなり多くの細胞外小胞が存在していると考えられている。体液を採取し、そこに含まれるエクソソームの中に、疾患のアイデンティティを示す分子を見出せれば、疾患診断の手がかりになりうる。実際、エクソソームによるリキッドバイオプシーの開発は世界中で活発化しており、現在、最も開発が進んでいる例として、アメリカのExosome Diagnostic社(現在はBio-Techne社に買収されている)が2016年に上市したExoDx LungシリーズやExoDx Prostateが挙げられる。これら検査は主にエクソソームに含まれるRNAを検出することで、ExoDx LungシリーズはALKやEGFRに対する分子標的薬のコンパニオン診断薬に[3]、ExoDx Prostateは3種類のRNA(PCA3、ERG、SPDEF)を測定することで、PSA検査で高値を示した患者に対して、前立腺生検の必要性を判断する際の補助診断薬としている[4,5]。特に、尿中エクソソームを解析するExoDx Prostateは2019年よりFDAからBreakthrough Device Designation(画期的医療機器/デバイス指定)を受け、臨床での実用が期待されている。日本でも、いくつかのベンチャー企業がエクソソームリキッドバイオプシーによる検査の実用化を目指しており、例えば、尿中のエクソソームmiRNAを標的としているCraif社や[6,7]、エクソソームタンパク質によるがん診断を目指しているテオリアサイエンス社[8,9]、涙液による乳がん診断法を開発しているTearExo社などが挙げられる[10,11]。今後も実用化に向けた動きは過熱すると思われる。
しかし、われわれは、リキッドバイオプシーにおける宝箱を開ける鍵は手に入れているのだろうか?この場合、宝箱を開ける鍵は、いくつかあると考えられる。一つは、疾患のアイデンティティを示す分子を明らかにすることだろう。特定の疾患における特異的なエクソソーム分子を明らかにすることができなければ、リキッドバイオプシーが成立しないため、これが文字通り鍵となる。そして2つ目の鍵は、特異的な分子をどのように検出するか、である。前述したように、われわれの体液中には多くの細胞外小胞が循環しているが、疾患に由来するエクソソームは、極わずかである。そのため、ノイズとなる正常細胞由来のエクソソームを掻き分け、重要アイテムが入っている疾患由来のエクソソームだけを開けなければ、永遠と空の宝箱を開けることとなる。エクソソーム中の目的分子を感度高く検出する方法が必要で、さらに、検出にはどのくらいの時間や手間、コストがかかるのかを吟味しなければならない。また、3つ目の鍵としては、検査に用いる検体の品質を一定にすることで、体液中のエクソソームの量や質を均一化することである。さらに現状定まっていない、インナーコントロールを定めることで、エクソソームの回収効率や個人差を考慮することができ、安定した検査結果へと繋がるだろう。
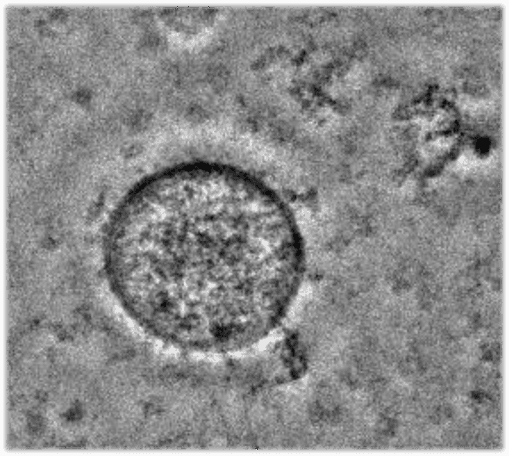
膵臓がん患者の血清に含まれるエクソソームの電子顕微鏡像。100 nmサイズのエクソソームの中身を電子顕微鏡では見ることはできないが、中には貴重なお宝が入っているかもしれない。
スケールバー : 100 nm
エクソソームは治療製剤になりうるか
ゲームにおいて宝箱は冒険の手助けになるアイテムが入っている。これは現実世界の宝箱であるエクソソームにおいても同様で、リキッドバイオプシーによる疾患診断の手助けになることに加えて、治療効果を有する分子(アイテム)が入っており、治療に用いることも可能である。その代表格は、間葉系幹細胞(MSC)に代表される幹細胞由来の細胞外小胞である。もともと、多分化能を持つMSCは再生医療の代表としても有望視されており、組織再生や機能回復に重要なサイトカインなどの液性因子を分泌していることが知られている[12,13]。近年、液性因子の一つであるエクソソームが損傷を起こした組織の修復に有効であることや抗炎症作用、抗線維化作用、免疫抑制作用などの様々な機能を示すことが注目されている。実際に、臨床試験においても治療効果が確認されており、オーストリアとドイツのグループは人工内耳装着による副反応の炎症を抑える目的として内耳に臍帯由来MSCの細胞外小胞を添加する臨床試験を行い、音声知覚の改善が認められた[14]。MSCの細胞外小胞による治療効果が得られる疾患は、肝硬変[15]、アルツハイマー[16]、慢性閉塞生肺疾患[17]、腎疾患[18]、リンパ浮腫[19]、変形性膝関節症[20]など多岐に渡り、現在、MSCの細胞外小胞を用いた臨床試験も世界中で多く行われている。この宝箱の中身であるmRNAを解析すると、歯髄由来のMSCからは神経形成に関する分子を、脂肪由来のMSCからは血管形成に関する分子が豊富に含まれており、両MSC由来EVに共通して発毛関連や皮膚基質関連の分子が多く含まれていた[21]。つまり、由来するMSCによってエクソソームの中身は少し異なるものの、いずれも組織修復や再生に関わる分子が多く含まれていた。日本でも慈恵医科大学らのグループを中心に、気道上皮細胞由来のエクソソームとなるが、特発性肺線維症に対する治療開発が行われ[22]、すでにPMDAとの対面助言まで進んでおり、臨床試験までの工程が見えてきており、実用化に期待がかかっている。
上記は、エクソソームそのものが治療効果を有していることを利用した例であるが、エクソソームに治療効果を付与したり、siRNAやmiRNA、低分子化合物を標的細胞に届けるための(宝箱ではなく)ギフトボックスとして、利用する例もある。この分野で、先陣を切って応用化を目指していたのはアメリカのCodiak Biosciences社であった。なぜ、過去形で記載しているか、結論から言うと、Codiak Biosciences社の計画は頓挫したからである。2022年8月末には大規模リストラを行い、社内整備を行なったものの、2023年3月には破産申告がされた。Codiak Biosciences社は改変型エクソソームを作製する技術に強みがある。Prostaglandin F2 receptor negative regulator (PTGFRN)をエクソソーム膜上に露出させることで、腫瘍への送達性をあげ、さらに、STING経路の活性化を誘導するSTINGアゴニストを内包させたエクソソーム(exoSTING) [23]、および、エクソソーム表面にIL–12 を搭載させ、IL–12ががん局所で作用するエクソソーム(exoIL–12)を開発し[24]、2020年にはこれらの臨床試験をスタートさせた。さらに、2021年にはLonza社がCodiak Biosciences社のエクソソーム製造設備を買収し、本格的なエクソソーム製剤の製造拠点を築こうとしていた。その矢先の破産申告であり、正確な原因は不明だが、臨床試験が上手く行かなかった可能性が考えられる。Codiak Biosciences社の例は、エクソソームという宝箱を開けることが一筋縄で行かないことを示した例と言えるだろう。Codiak Biosciences社がエクソソーム製剤を実用化できなかった正確な理由は分からないが、エクソソームを治療用製剤に用いる際の鍵となるポイントについて考えてみよう。一つは、エクソソームの安定的な供給が必須であり、そのためのGMPグレードの細胞の大量培養系および高効率かつ純度の高いエクソソームの回収方法の存在が不可欠である点が挙げられる。現状、特に後者のエクソソーム回収法についてはベストな方法が長い間、模索されているにも関わらず、決定打に欠けている。もう一つは、エクソソームが分子の複合体であることに起因して、治療効果を発揮する分子がどれであるのか特定できない、そして、作用機序が明らかではない場合があることだ。例えば、MSC由来のエクソソームが抗炎症作用を示すという場合でも、エクソソーム中に存在する多数の分子のうち、どの分子が抗炎症作用を発揮しているか分からないし、単一の分子とも限らず、複数存在している可能性もある。主となる分子や作用機序が不明でも治療薬として使用することは可能なのだが、生産過程における品質管理の際に、治療効果を有するエクソソームがどの程度含まれているのか、目的外のエクソソームがどの程度含まれているのかを評価する系や治療効果を安定的に評価できる系の構築が求められるだろう。
おわりに
エクソソームという宝箱を開けるための鍵は、徐々に揃い始めてきた。特に、リキッドバイオプシーの分野では、宝箱の中身が次々と開けられ、どの細胞に由来するのか、そのメッセージを解き明かそうと様々な解析・探索が行われてきた。ただし、今までの報告は、小規模な解析検体数であったり、単一施設による限定的な状況の結果であることが多く、実用化に向けて、更なる検証が必要だろう。また、エクソソームを用いた治療製剤の開発についても課題は多いものの、着実に進んでいることが窺える。その理由の一つに、PMDAが2021年に、エクソソームを含む細胞外小胞(EV)を利用した治療用製剤に関する専門部会を立ち上げて、2023年1月に報告書をまとめたことからも、細胞外小胞を治療用製剤に用いることがすでに想定されているのだろう。エクソソームが私たちの身近な生活に入ってくるのはまだ先かもしれないが、どんなRPGだって、最初からレベル99でラスボスを倒すところからは始まらず、レベル1から進めて行くしかないのと同じで、ちょっとずつエンディングを目指すしかない。そうして、エンディングに辿り着くころには、毎年、エクソソームによる疾患検査を受けて、疾患が見つかればエクソソーム治療製剤で治療し、日頃の健康維持のためにエクソソーム入りの健康食品を食べ、肌のハリを保つため、エクソソーム入りの化粧水を使い、薄くなった頭皮にエクソソーム入り育毛剤を使っている将来があるかもしれない。
ちなみに、ゲーム内では時たま宝箱を開けるとお宝ではなく、敵(ミミック)が現れて、痛い目を見ることがある。このパターンはエクソソームにも存在している。それは、がん細胞などのエクソソームである。リキッドバイオプシーの観点から見ると、診断の手助けするお宝が入っているように見えるが、がん細胞のエクソソームは、がん悪性化に繋がる分子を豊富に含み、実際に転移などの悪性化を引き起こす要因の一つとなっており、悪玉エクソソームと位置付けできる[25] [26] [27]。しかし、ゲーム内では、ミミックを倒すとアイテムを貰えることが多くあり、お宝があることには違いないので、筆者は、“この宝箱はミミックだ”と分かっていても開けるタイプである。その性格とは関係ないのだろうが、がん細胞エクソソームを倒して(解析して)、お宝である疾患のメカニズム解明に繋がる研究も好きである。

■参考文献
- C. Théry, K.W. Witwer, E. Aikawa, M.J. Alcaraz, J.D. Anderson, R. Andriantsitohaina, A. Antoniou, T. Arab, F. Archer, G.K. Atkin-Smith, D.C. Ayre, J.M. Bach, D. Bachurski, H. Baharvand, L. Balaj, S. Baldacchino, N.N. Bauer, A.A. Baxter, M. Bebawy, C. Beckham, A. Bedina Zavec, A. Benmoussa, A.C. Berardi, P. Bergese, E. Bielska, C. Blenkiron, S. Bobis-Wozowicz, E. Boilard, W. Boireau, A. Bongiovanni, F.E. Borràs, S. Bosch, C.M. Boulanger, X. Breakefield, A.M. Breglio, M. Brennan, D.R. Brigstock, A. Brisson, M.L. Broekman, J.F. Bromberg, P. Bryl-Górecka, S. Buch, A.H. Buck, D. Burger, S. Busatto, D. Buschmann, B. Bussolati, E.I. Buzás, J.B. Byrd, G. Camussi, D.R. Carter, S. Caruso, L.W. Chamley, Y.T. Chang, C. Chen, S. Chen, L. Cheng, A.R. Chin, A. Clayton, S.P. Clerici, A. Cocks, E. Cocucci, R.J. Coffey, A. Cordeiro-da-Silva, Y. Couch, F.A. Coumans, B. Coyle, R. Crescitelli, M.F. Criado, C. D’Souza-Schorey, S. Das, A. Datta Chaudhuri, P. de Candia, E.F. De Santana, O. De Wever, H.A. Del Portillo, T. Demaret, S. Deville, A. Devitt, B. Dhondt, D. Di Vizio, L.C. Dieterich, V. Dolo, A.P. Dominguez Rubio, M. Dominici, M.R. Dourado, T.A. Driedonks, F.V. Duarte, H.M. Duncan, R.M. Eichenberger, K. Ekström, S. El Andaloussi, C. Elie-Caille, U. Erdbrügger, J.M. Falcón-Pérez, F. Fatima, J.E. Fish, M. Flores-Bellver, A. Försönits, A. Frelet-Barrand, F. Fricke, G. Fuhrmann, S. Gabrielsson, A. Gámez-Valero, C. Gardiner, K. Gärtner, R. Gaudin, Y.S. Gho, B. Giebel, C. Gilbert, M. Gimona, I. Giusti, D.C. Goberdhan, A. Görgens, S.M. Gorski, D.W. Greening, J.C. Gross, A. Gualerzi, G.N. Gupta, D. Gustafson, A. Handberg, R.A. Haraszti, P. Harrison, H. Hegyesi, A. Hendrix, A.F. Hill, F.H. Hochberg, K.F. Hoffmann, B. Holder, H. Holthofer, B. Hosseinkhani, G. Hu, Y. Huang, V. Huber, S. Hunt, A.G. Ibrahim, T. Ikezu, J.M. Inal, M. Isin, A. Ivanova, H.K. Jackson, S. Jacobsen, S.M. Jay, M. Jayachandran, G. Jenster, L. Jiang, S.M. Johnson, J.C. Jones, A. Jong, T. Jovanovic-Talisman, S. Jung, R. Kalluri, S.I. Kano, S. Kaur, Y. Kawamura, E.T. Keller, D. Khamari, E. Khomyakova, A. Khvorova, P. Kierulf, K.P. Kim, T. Kislinger, M. Klingeborn, D.J. Klinke, 2nd, M. Kornek, M.M. Kosanović, F. Kovács Á, E.M. Krämer-Albers, S. Krasemann, M. Krause, I.V. Kurochkin, G.D. Kusuma, S. Kuypers, S. Laitinen, S.M. Langevin, L.R. Languino, J. Lannigan, C. Lässer, L.C. Laurent, G. Lavieu, E. Lázaro-Ibáñez, S. Le Lay, M.S. Lee, Y.X.F. Lee, D.S. Lemos, M. Lenassi, A. Leszczynska, I.T. Li, K. Liao, S.F. Libregts, E. Ligeti, R. Lim, S.K. Lim, A. Linē, K. Linnemannstöns, A. Llorente, C.A. Lombard, M.J. Lorenowicz, M. Lörincz Á, J. Lötvall, J. Lovett, M.C. Lowry, X. Loyer, Q. Lu, B. Lukomska, T.R. Lunavat, S.L. Maas, H. Malhi, A. Marcilla, J. Mariani, J. Mariscal, E.S. Martens-Uzunova, L. Martin-Jaular, M.C. Martinez, V.R. Martins, M. Mathieu, S. Mathivanan, M. Maugeri, L.K. McGinnis, M.J. McVey, D.G. Meckes, Jr., K.L. Meehan, I. Mertens, V.R. Minciacchi, A. Möller, M. Møller Jørgensen, A. Morales-Kastresana, J. Morhayim, F. Mullier, M. Muraca, L. Musante, V. Mussack, D.C. Muth, K.H. Myburgh, T. Najrana, M. Nawaz, I. Nazarenko, P. Nejsum, C. Neri, T. Neri, R. Nieuwland, L. Nimrichter, J.P. Nolan, E.N. Nolte-‘t Hoen, N. Noren Hooten, L. O’Driscoll, T. O’Grady, A. O’Loghlen, T. Ochiya, M. Olivier, A. Ortiz, L.A. Ortiz, X. Osteikoetxea, O. Østergaard, M. Ostrowski, J. Park, D.M. Pegtel, H. Peinado, F. Perut, M.W. Pfaffl, D.G. Phinney, B.C. Pieters, R.C. Pink, D.S. Pisetsky, E. Pogge von Strandmann, I. Polakovicova, I.K. Poon, B.H. Powell, I. Prada, L. Pulliam, P. Quesenberry, A. Radeghieri, R.L. Raffai, S. Raimondo, J. Rak, M.I. Ramirez, G. Raposo, M.S. Rayyan, N. Regev-Rudzki, F.L. Ricklefs, P.D. Robbins, D.D. Roberts, S.C. Rodrigues, E. Rohde, S. Rome, K.M. Rouschop, A. Rughetti, A.E. Russell, P. Saá, S. Sahoo, E. Salas-Huenuleo, C. Sánchez, J.A. Saugstad, M.J. Saul, R.M. Schiffelers, R. Schneider, T.H. Schøyen, A. Scott, E. Shahaj, S. Sharma, O. Shatnyeva, F. Shekari, G.V. Shelke, A.K. Shetty, K. Shiba, P.R. Siljander, A.M. Silva, A. Skowronek, O.L. Snyder, 2nd, R.P. Soares, B.W. Sódar, C. Soekmadji, J. Sotillo, P.D. Stahl, W. Stoorvogel, S.L. Stott, E.F. Strasser, S. Swift, H. Tahara, M. Tewari, K. Timms, S. Tiwari, R. Tixeira, M. Tkach, W.S. Toh, R. Tomasini, A.C. Torrecilhas, J.P. Tosar, V. Toxavidis, L. Urbanelli, P. Vader, B.W. van Balkom, S.G. van der Grein, J. Van Deun, M.J. van Herwijnen, K. Van Keuren-Jensen, G. van Niel, M.E. van Royen, A.J. van Wijnen, M.H. Vasconcelos, I.J. Vechetti, Jr., T.D. Veit, L.J. Vella, É. Velot, F.J. Verweij, B. Vestad, J.L. Viñas, T. Visnovitz, K.V. Vukman, J. Wahlgren, D.C. Watson, M.H. Wauben, A. Weaver, J.P. Webber, V. Weber, A.M. Wehman, D.J. Weiss, J.A. Welsh, S. Wendt, A.M. Wheelock, Z. Wiener, L. Witte, J. Wolfram, A. Xagorari, P. Xander, J. Xu, X. Yan, M. Yáñez-Mó, H. Yin, Y. Yuana, V. Zappulli, J. Zarubova, V. Žėkas, J.Y. Zhang, Z. Zhao, L. Zheng, A.R. Zheutlin, A.M. Zickler, P. Zimmermann, A.M. Zivkovic, D. Zocco, E.K. Zuba-Surma, Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines, J Extracell Vesicles. 7 (1) (2018) 1535750, https://doi.org/10.1080/20013078.2018.1535750.
- R.T. Morales, J. Ko, Future of Digital Assays to Resolve Clinical Heterogeneity of Single Extracellular Vesicles, ACS Nano. 16 (8) (2022) 11619-11645, https://doi.org/10.1021/acsnano.2c04337.
- E. Castellanos-Rizaldos, D.G. Grimm, V. Tadigotla, J. Hurley, J. Healy, P.L. Neal, M. Sher, R. Venkatesan, C. Karlovich, M. Raponi, A. Krug, M. Noerholm, J. Tannous, B.A. Tannous, L.E. Raez, J.K. Skog, Exosome-Based Detection of EGFR T790M in Plasma from Non-Small Cell Lung Cancer Patients, Clin Cancer Res. 24 (12) (2018) 2944-2950, https://doi.org/10.1158/1078-0432.Ccr-17-3369.
- R. Tutrone, M.J. Donovan, P. Torkler, V. Tadigotla, T. McLain, M. Noerholm, J. Skog, J. McKiernan, Clinical utility of the exosome based ExoDx Prostate (IntelliScore) EPI test in men presenting for initial Biopsy with a PSA 2-10 ng/mL, Prostate Cancer Prostatic Dis. 23 (4) (2020) 607-614, https://doi.org/10.1038/s41391-020-0237-z.
- R. Tutrone, B. Lowentritt, B. Neuman, M.J. Donovan, E. Hallmark, T.J. Cole, Y. Yao, C. Biesecker, S. Kumar, V. Verma, G.R. Sant, J. Alter, J. Skog, ExoDx prostate test as a predictor of outcomes of high-grade prostate cancer – an interim analysis, Prostate Cancer Prostatic Dis (2023), https://doi.org/10.1038/s41391-023-00675-1.
- T. Yasui, T. Yanagida, S. Ito, Y. Konakade, D. Takeshita, T. Naganawa, K. Nagashima, T. Shimada, N. Kaji, Y. Nakamura, I.A. Thiodorus, Y. He, S. Rahong, M. Kanai, H. Yukawa, T. Ochiya, T. Kawai, Y. Baba, Unveiling massive numbers of cancer-related urinary-microRNA candidates via nanowires, Sci Adv. 3 (12) (2017) e1701133, https://doi.org/10.1126/sciadv.1701133.
- Y. Kitano, K. Aoki, F. Ohka, S. Yamazaki, K. Motomura, K. Tanahashi, M. Hirano, T. Naganawa, M. Iida, Y. Shiraki, T. Nishikawa, H. Shimizu, J. Yamaguchi, S. Maeda, H. Suzuki, T. Wakabayashi, Y. Baba, T. Yasui, A. Natsume, Urinary MicroRNA-Based Diagnostic Model for Central Nervous System Tumors Using Nanowire Scaffolds, ACS Appl Mater Interfaces. 13 (15) (2021) 17316-17329, https://doi.org/10.1021/acsami.1c01754.
- Y. Yoshioka, M. Shimomura, K. Saito, H. Ishii, Y. Doki, H. Eguchi, T. Nakatsura, T. Itoi, M. Kuroda, M. Mori, T. Ochiya, Circulating cancer-associated extracellular vesicles as early detection and recurrence biomarkers for pancreatic cancer, Cancer Sci. 113 (10) (2022) 3498-3509, https://doi.org/10.1111/cas.15500.
- Y. Yoshioka, N. Kosaka, Y. Konishi, H. Ohta, H. Okamoto, H. Sonoda, R. Nonaka, H. Yamamoto, H. Ishii, M. Mori, K. Furuta, T. Nakajima, H. Hayashi, H. Sugisaki, H. Higashimoto, T. Kato, F. Takeshita, T. Ochiya, Ultra-sensitive liquid biopsy of circulating extracellular vesicles using ExoScreen, Nat Commun. 5 (2014) 3591, https://doi.org/10.1038/ncomms4591.
- T. Takeuchi, K. Mori, H. Sunayama, E. Takano, Y. Kitayama, T. Shimizu, Y. Hirose, S. Inubushi, R. Sasaki, H. Tanino, Antibody-Conjugated Signaling Nanocavities Fabricated by Dynamic Molding for Detecting Cancers Using Small Extracellular Vesicle Markers from Tears, J Am Chem Soc. 142 (14) (2020) 6617-6624, https://doi.org/10.1021/jacs.9b13874.
- K. Mori, M. Hirase, T. Morishige, E. Takano, H. Sunayama, Y. Kitayama, S. Inubushi, R. Sasaki, M. Yashiro, T. Takeuchi, A Pretreatment-Free, Polymer-Based Platform Prepared by Molecular Imprinting and Post-Imprinting Modifications for Sensing Intact Exosomes, Angew Chem Int Ed Engl. 58 (6) (2019) 1612-1615, https://doi.org/10.1002/anie.201811142.
- Y. Han, X. Li, Y. Zhang, Y. Han, F. Chang, J. Ding, Mesenchymal Stem Cells for Regenerative Medicine, Cells. 8 (8) (2019), https://doi.org/10.3390/cells8080886.
- S. Fernández-Francos, N. Eiro, L.A. Costa, S. Escudero-Cernuda, M.L. Fernández-Sánchez, F.J. Vizoso, Mesenchymal Stem Cells as a Cornerstone in a Galaxy of Intercellular Signals: Basis for a New Era of Medicine, Int J Mol Sci. 22 (7) (2021), https://doi.org/10.3390/ijms22073576.
- A. Warnecke, N. Prenzler, J. Harre, U. Köhl, L. Gärtner, T. Lenarz, S. Laner-Plamberger, G. Wietzorrek, H. Staecker, T. Lassacher, J. Hollerweger, M. Gimona, E. Rohde, First-in-human intracochlear application of human stromal cell-derived extracellular vesicles, J Extracell Vesicles. 10 (8) (2021) e12094, https://doi.org/10.1002/jev2.12094.
- S. Takeuchi, A. Tsuchiya, T. Iwasawa, S. Nojiri, T. Watanabe, M. Ogawa, T. Yoshida, K. Fujiki, Y. Koui, T. Kido, Y. Yoshioka, M. Fujita, J. Kikuta, T. Itoh, M. Takamura, K. Shirahige, M. Ishii, T. Ochiya, A. Miyajima, S. Terai, Small extracellular vesicles derived from interferon-γ pre-conditioned mesenchymal stromal cells effectively treat liver fibrosis, NPJ Regen Med. 6 (1) (2021) 19, https://doi.org/10.1038/s41536-021-00132-4.
- X. Ma, M. Huang, M. Zheng, C. Dai, Q. Song, Q. Zhang, Q. Li, X. Gu, H. Chen, G. Jiang, Y. Yu, X. Liu, S. Li, G. Wang, H. Chen, L. Lu, X. Gao, ADSCs-derived extracellular vesicles alleviate neuronal damage, promote neurogenesis and rescue memory loss in mice with Alzheimer’s disease, J Control Release. 327 (2020) 688-702, https://doi.org/10.1016/j.jconrel.2020.09.019.
- N. Ridzuan, N. Zakaria, D. Widera, J. Sheard, M. Morimoto, H. Kiyokawa, S.A. Mohd Isa, G.K. Chatar Singh, K.Y. Then, G.C. Ooi, B.H. Yahaya, Human umbilical cord mesenchymal stem cell-derived extracellular vesicles ameliorate airway inflammation in a rat model of chronic obstructive pulmonary disease (COPD), Stem Cell Res Ther. 12 (1) (2021) 54, https://doi.org/10.1186/s13287-020-02088-6.
- E. Xiang, B. Han, Q. Zhang, W. Rao, Z. Wang, C. Chang, Y. Zhang, C. Tu, C. Li, D. Wu, Human umbilical cord-derived mesenchymal stem cells prevent the progression of early diabetic nephropathy through inhibiting inflammation and fibrosis, Stem Cell Res Ther. 11 (1) (2020) 336, https://doi.org/10.1186/s13287-020-01852-y.
- K. Tashiro, Y. Yoshioka, T. Ochiya, Extracellular vesicles from adipose-derived stem cells relieve extremity lymphedema in mouse models, Plast Reconstr Surg (2023), https://doi.org/10.1097/prs.0000000000010388.
- H. Hanai, D.A. Hart, G. Jacob, K. Shimomura, W. Ando, Y. Yoshioka, T. Ochiya, S. Nakagawa, M. Nakamura, S. Okada, N. Nakamura, Small extracellular vesicles derived from human adipose-derived mesenchymal stromal cells cultured in a new chemically-defined contaminate-free media exhibit enhanced biological and therapeutic effects on human chondrocytes in vitro and in a mouse osteoarthritis model, J Extracell Vesicles. 12 (7) (2023) e12337, https://doi.org/10.1002/jev2.12337.
- A. Terunuma, Y. Yoshioka, T. Sekine, T. Takane, Y. Shimizu, S. Narita, T. Ochiya, H. Terunuma, Extracellular vesicles from mesenchymal stem cells of dental pulp and adipose tissue display distinct transcriptomic characteristics suggestive of potential therapeutic targets, J Stem Cells Regen Med. 17 (2) (2021) 56-60, https://doi.org/10.46582/jsrm.1702009.
- T. Kadota, Y. Fujita, J. Araya, N. Watanabe, S. Fujimoto, H. Kawamoto, S. Minagawa, H. Hara, T. Ohtsuka, Y. Yamamoto, K. Kuwano, T. Ochiya, Human bronchial epithelial cell-derived extracellular vesicle therapy for pulmonary fibrosis via inhibition of TGF-β-WNT crosstalk, J Extracell Vesicles. 10 (10) (2021) e12124, https://doi.org/10.1002/jev2.12124.
- S.C. Jang, K.D. Economides, R.J. Moniz, C.L. Sia, N. Lewis, C. McCoy, T. Zi, K. Zhang, R.A. Harrison, J. Lim, J. Dey, M. Grenley, K. Kirwin, N.L. Ross, R. Bourdeau, A. Villiger-Oberbek, S. Estes, K. Xu, J. Sanchez-Salazar, K. Dooley, W.K. Dahlberg, D.E. Williams, S. Sathyanarayanan, ExoSTING, an extracellular vesicle loaded with STING agonists, promotes tumor immune surveillance, Commun Biol. 4 (1) (2021) 497, https://doi.org/10.1038/s42003-021-02004-5.
- N.D. Lewis, C.L. Sia, K. Kirwin, S. Haupt, G. Mahimkar, T. Zi, K. Xu, K. Dooley, S.C. Jang, B. Choi, A. Boutin, A. Grube, C. McCoy, J. Sanchez-Salazar, M. Doherty, L. Gaidukov, S. Estes, K.D. Economides, D.E. Williams, S. Sathyanarayanan, Exosome Surface Display of IL12 Results in Tumor-Retained Pharmacology with Superior Potency and Limited Systemic Exposure Compared with Recombinant IL12, Mol Cancer Ther. 20 (3) (2021) 523-534, https://doi.org/10.1158/1535-7163.Mct-20-0484.
- Y. Kiya, Y. Yoshioka, Y. Nagakawa, T. Ochiya, Extracellular Vesicles Are Important Mediators That Regulate Tumor Lymph Node Metastasis via the Immune System, Int J Mol Sci. 24 (2) (2023), https://doi.org/10.3390/ijms24021362.
- Y. Naito, Y. Yoshioka, T. Ochiya, Intercellular crosstalk between cancer cells and cancer-associated fibroblasts via extracellular vesicles, Cancer Cell Int. 22 (1) (2022) 367, https://doi.org/10.1186/s12935-022-02784-8.
- T. Tamura, Y. Yoshioka, S. Sakamoto, T. Ichikawa, T. Ochiya, Extracellular vesicles in bone homeostasis: key roles of physiological and pathological conditions, J Bone Miner Metab. 41 (3) (2023) 345-357, https://doi.org/10.1007/s00774-022-01362-2.
掲載元:EVs エクソソームを含む細胞外小胞ハンドブック

