松本 弦 博士
長崎大学大学院 医歯薬学総合研究科(医学系)
量子科学技術研究開発機構 脳機能イメージング研究部

はじめに
神経細胞は生まれてから死ぬまで増殖することなく生き続ける特別な細胞です。人の脳にはおよそ1,000億個の神経細胞があると言われており、120年以上も生きていける能力を有していると考えられています。しかしながら、神経細胞は“不死”の細胞ではないので、時間とともにその数は減っていきます。認知症は、大脳皮質や大脳辺縁系などの脳の認知機能を担う領域の神経細胞が、自然に脱落していくよりも速く、病的に死んでしまうことにより発症すると考えられています。認知症は、アルツハイマー型認知症、レビー小体型認知症、前頭側頭型認知症と脳血管性認知症などに分類されます。脳血管性認知症は、脳梗塞などの脳血流障害によって認知機能を担う脳領域の神経細胞を失うことによるもので、全体の約20%を占めます。認知症の中ではアルツハイマー型認知症はもっとも患者数が多く、認知症全体の約60%を占めています。アルツハイマー型認知症は、海馬体の萎縮が顕著に見られるのに対し、レビー小体型認知症では、アルツハイマー型認知症ではあまり見られない後頭葉での血流低下が見られます。また、ハリウッド映画俳優のブルース・ウィリス氏が患ったことでも知られる前頭側頭型認知症では、大脳皮質の前頭葉と側頭葉の顕著な萎縮が見られるのに対して、海馬体の萎縮はあまり見られないなどの特徴があります。これらの疾患は原因となるタンパク質や影響される脳領域は異なりますが、疾患領域にある神経細胞内にはタンパク質の凝集体が蓄積しており、疾患の進行とともに凝集体の蓄積する脳領域が拡がっていくという共通の特徴があります。
アルツハイマー病とタウの凝集
アルツハイマー病(Alzheimer’s disease : AD)はアルツハイマー型認知症の原因疾患で、脳組織内に老人斑と神経原線維変化(neurofibrillary tangle : NFT)の両方が出現する疾患として病理学的に定義されています1)。老人斑とは、アミロイドβペプチド(Aβ)がその主要構成成分として細胞外で沈着するタンパク質凝集体で、リン酸化タウタンパク質やユビキチン化タンパク質も一部含まれています。Aβは、神経細胞の膜表面にあるアミロイド前駆体タンパク質(amyloid precursor protein : APP)が、細胞膜にあるプロテアーゼによって切り出されることにより生成されます2)。これまでAβがアルツハイマー病の主要な原因因子であると考えられてきたため、この細胞外のアミロイド沈着を抑制し、排除する多数の方法が考案され、アデュカヌマブなどの抗体医薬品も開発されてきました。しかしながら、Aβの沈着による老人斑の形成はアルツハイマー病を特徴づけるものではありますが、脳の萎縮はAβの沈着とは相関がないことも知られています2)~5)。
ADのもう一つの病態であるNFTは、神経の軸索に存在する微小管結合タンパク質であるタウタンパク質が線維化して細胞内に蓄積する病態です。NFTを起こす線維化したタウタンパク質は、過剰なリン酸化とユビキチン化を受けており、リン酸化タウを検出することで病理学的に同定されます。リン酸化タウの細胞内凝集によるNFTは、AD以外にも前頭側頭型認知症の原因となる前頭側頭葉変性症(frontotemporal lobar degeneration : FTLD)や後述する高齢者タウオパチーなどでも観察されます。NFTは健常者脳では観察されず、疾患領域の神経細胞内のみに生じる病態であり、タウの沈着を伴うNFTの進行度合いと脳萎縮には強い相関関係が見られることなどから、タウ凝集によるNFTの形成がADにおける神経細胞死の主要な要因であると考えられます2)、4)。一般に、NFTを含むタウタンパク質の線維化を伴う疾患はタウオパチー(tauopathy)と呼ばれ、ADやFTLDなどの認知症だけではなく、大脳基底核の疾患で運動障害を伴う進行性核上性麻痺(progressive supranuclearpalsy : PSP)や大脳皮質基底核変性症(corticobasaldegeneration : CBD)などでも異常なタウタンパク質凝集が蓄積します。
後期高齢者の正常な加齢によっても、海馬体領域を中心にリン酸化タウ凝集体の沈着によるNFTが見られることも知られており、「高齢者タウオパチー」と呼ばれています5)。高齢者タウオパチーは、病理学的には原発性年齢関連タウオパチー(primary age-related tauopathy : PART)と呼ばれ、臨床的には神経原線維変化型老年期認知症(senile dementia of the NFT type : SD-NFT)と呼ばれます。どちらも同じ病態を示す言葉ではありますが、ADと決定的に異なるのは、PARTにはAβの沈着による老人斑が見られないことです。SD-NFTでは、Aβの沈着が存在しなくても臨床症状としてアルツハイマー型認知症と同様の認知機能の低下が見られます。また、高齢発症の認知症ではADと診断されている症例の中に、病理学的には「高齢者タウオパチー」に入ると考えられるものがかなり存在します。これらのことは、アルツハイマー型認知症の臨床症状は老人斑がなくても生じ得ることを示唆しており、アルツハイマー病を引き起こす病的な神経細胞死の原因として、タウの凝集が大きく関わっていると言えるでしょう。
タウ凝集体モデルと認知症治療薬開発
認知症の根本的な治療薬を開発していくためには、タウが神経細胞内でどのようにして凝集して神経細胞死を誘導し、それが認知症につながっていくのかを理解する必要があります。タウは非常に熱安定性の高いタンパク質で、タウを培養細胞に大過剰発現させても凝集体を形成することはありません。なぜ疾患神経細胞でタウ凝集が起こるのかについては未だ解明されていませんが、タウタンパク質は、線維化した異常構造をもつタウが、正常なタウの構造を異常型に変換することで線維伸長をすること、プリオンと同じような増殖機能を有していることが知られています6)。つまり、一度タウ線維ができてしまえば、それが凝集核(シード)となり、正常なタウを原料として線維化タウが増殖していくということです。この性質を利用して、線維化タウのシードをタウを発現した培養細胞に導入すると、細胞内でタウの線維化を誘導することができます。タウタンパク質は神経細胞の軸索に局在するタンパク質で、神経細胞特異的に発現するので、一般的な培養細胞にはほとんど存在していません。我々の研究室では、GFPをつけた全長のタウ(P301L)を安定発現させた細胞株を作成し、その細胞株に線維化タウを導入して細胞内タウ凝集体をもつ細胞をクローン化した図1のようなタウ凝集細胞株を樹立しています7)。この細胞株では、線維化タウが恒常的に維持されているので、タウ凝集体を同じ条件で解析することができます。これにより、タウの凝集体を細胞内から排除するような薬剤のスクリーニングや、in vitroでスクリーニングしたタウ凝集抑制剤を細胞レベルで評価することができるようになりました。我々の研究室では、タウ凝集体の細胞内分解過程の研究を通じて、細胞内でタウ凝集体を分解してなくすことができる新しい化合物の研究開発を行っています。
タウ線維の導入によるタウの線維化は、培養細胞だけではなく、マウスの脳へ直接線維化タウをインジェクションすることでも誘導できます。我々の研究室では、タウ(P301S)を神経特異的に発現するトランスジェニックマウス(PS19マウス)を導入して、タウの凝集体形成とその分解についての研究をおこなっています。PS19マウスは、世界中でよく使われているタウオパチーモデルマウスで、自発的なリン酸化タウの凝集体の蓄積が8ヵ月齢くらいから観察され、10ヵ月齢を過ぎると大脳皮質と海馬体の萎縮が始まり、13ヵ月齢あたりで寿命を迎えます。20 週齢のPS19マウスではタウ凝集体の蓄積は観察されませんが、線維化タウシードを海馬領域に直接インジェクションすると、わずか2週間で海馬や歯状回にタウ凝集体が観察できます(図2)。このことは、タウシードが神経細胞に取り込まれて神経細胞内でタウ凝集体の形成を誘導したことを示唆しており、凝集体形成の時期をコントロールできることを示していると言えます。このインジェクションモデルを使うことで、投薬実験などの創薬研究において、飼育期間と投薬期間の短縮が見込めます。しかしながら、タウオパチーモデルマウスへのインジェクションでは早期にタウ凝集体が観察できますが、野生型マウスにインジェクションしてもタウ凝集体の形成はほとんど観察できません。野生型タウは微小管に結合すると構造が非常に安定化するため、培養細胞へのシード導入であっても、野生型タウの凝集体を形成させることは困難です。実際、タウオパチーモデルマウスのほとんどがP301S/Lの変異体を使っています。ヒトの疾患では、野生型タウが凝集体を形成していますので、野生型タウが凝集体を作るような条件を見つけて、今後細胞モデルや動物モデルをつくっていくことで、タウオパチー発症の分子機構が解明されていくと期待されます。
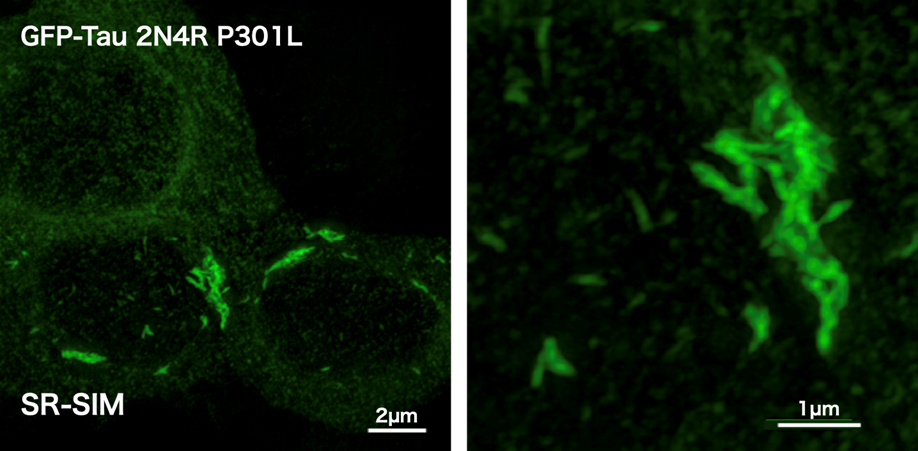
HEK293細胞にGFPを付加した全長のP301L変異型タウ(GFP-Tau 2N4R P301L)を安定発現させた細胞株に4Rタウ線維化タンパク質(P301L変異)(TAU02)をリポフェクションにより導入した。構造化照明超解像顕微鏡(SR-SIM)により線維化したタウ凝集体を可視化した。微小な線維化したタウ凝集体が無数に細胞質に形成され、微小タウ線維が会合して大きなタウ凝集体を形成していることが観察された7)。
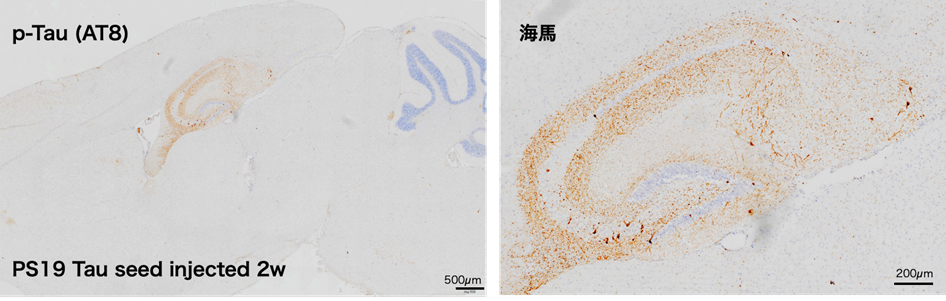
20週齢のタウオパチーモデルマウス(PS19 ; B6 ; C3-Tg(Prnp-MAPT*P301S)PS19Vle/J)8)の海馬に4Rタウ線維化タンパク質(P301L変異)(TAU02)をインジェクトした。2週間後に脳を摘出し、矢状断切片を作成してタウ凝集体を抗リン酸化タウ抗体(AT8)で、核をヘマトキシリンで染色した。22週齢のPS19マウスではAT8陽性のタウは検出されないが、シードをインジェクションした海馬では、AT8陽性の凝集体が観察された。
おわりに
タウ凝集体がADを含むタウオパチーにおける神経細胞死に関与していることは、タウ病理だけで認知機能障害が引き起こされることなどから、おそらく間違いないと思われます2)、5)、9)。タウ凝集体は神経細胞の中でできて、神経細胞の中に沈着しますので、細胞の外から抗体などでアプローチするのは難しいと思われます。タウ凝集体がなくなれば、神経細胞死も抑制されるのかどうかについては、凝集体をなくしてみなければ実証できませんが、それでもタウが凝集体を形成して沈着する前に細胞死は起こらないことを考えれば、凝集体を細胞内で分解して除去してしまうことが、単純で確実な治療方法であると言えるでしょう。問題はどうやって分解除去するのかということになりますが、我々の研究室で開発している化合物はタウ凝集体の分解を促進して凝集体を減らすことができることもわかってきています。今後、このような化合物を、タウ凝集細胞モデルやタウシードインジェクションモデルマウスなどを使ってスクリーニングし、検証していくことで、将来、認知症を克服できような新薬が誕生するかもしれません。
■参考文献
- Alzheimer A (1907) Ueber eine eigen- artige Erkrankung der Hirnrinde. Allgemeine Zeitschrift für Psychiatrie und psychisch-gerichtliche Medizin, 64:146-148.
- Giannakopoulos, P. et al. (2003) Tangle and neuron numbers, but not amyloid load, predict cognitive status in Alzheimer’s disease, NeurologyM 60: 1495-1500
- 森啓・編 ; 認知症.実験医学,35(12),2017
- Delacourte A, Sergeant N, Wattez A, et al. (2002) Tau aggregation in the hippocampal formation: an ageing or a pathological process?, Exp Gerontol. 37: 1291e1296.
- 山田正仁 : Primary age-related tauopathy (PART) (原発性年齢関連タウオパチー) : 認知機能正常から神経原線維変化型老年期認知症までを含む新たな病理学的用語.日本臨床,74(3): 471-475,2016
- Sanders, D., Kaufman, S., DeVos, S., Sharma, A., Mirbaha, H., Li, A., Barker, S., Foley, A., Thorpe, J., Serpell, L., Miller, T., Grinberg, L., Seeley, W., Diamond, M. (2014). Distinct Tau Prion Strains Propagate in Cells and Mice and Define Different Tauopathies, Neuron 82: 1271-1288.
- Matsumoto, G., Matsumoto, K., Kimura, T., Suhara, T., Higuchi, M., Sahara, N.,Mori, N. (2018). Tau Fibril Formation in Cultured Cells Compatible with a Mouse Model of Tauopathy. Int. J. Mol. Sci. 19: 1497.
- Yoshiyama, Y., Higuchi, M., Zhang, B., Huang, S., Iwata, N., Saido, T., Maeda, J.,Suhara, T., Trojanowski, J., Lee, V. (2007). Synapse Loss and Microglial Activation Precede Tangles in a P301S Tauopathy Mouse Model. Neuron 53: 337-351
- Guo, J., Buist, A., Soares, A., Callaerts, K., Calafate, S., Stevenaert, F., Daniels, J., Zoll, B., Crowe, A., Brunden, K., Moechars, D., Lee, V. (2016). The Dynamics and Turnover of Tau Aggregates in Cultured Cells INSIGHTS INTO THERAPIES FOR TAUOPATHIES, J. Biol. Chem. 291: 13175-13193.
関連商品情報
掲載元:コスモバイオニュース 198号

