工藤 保誠
徳島大学 大学院医歯薬学研究部 口腔生命科学分野
徳島大学 フォトニクス健康フロンティア研究院 実験腫瘍学部門

はじめに:細胞周期の厳密な制御とその破綻
細胞の増殖過程において、細胞周期調節因子の多くがユビキチン分解によって、タンパク質の量的・質的制御を受け、細胞周期の円滑な進行に重要な役割を果たしている。細胞周期は、G1期、S期、G2期、M期という4つの段階から構成され、これを正確に進行させることは、生命活動の基本である。特に多細胞生物においては、細胞の増殖・分化・死のバランスが個体の恒常性に直結しており、細胞周期の制御機構の破綻は、がんや加齢関連疾患など多くの病態に関与している。この細胞周期を厳密に制御するための鍵となるのが、「ユビキチン-プロテアソーム経路(UPS)」によるタンパク質分解である。UPSによるタンパク分解は、生命活動の場で広範な役割を担っており、その制御異常は、がん、神経変性疾患などの様々な疾病に関与することが明らかにされつつある。
細胞周期制御
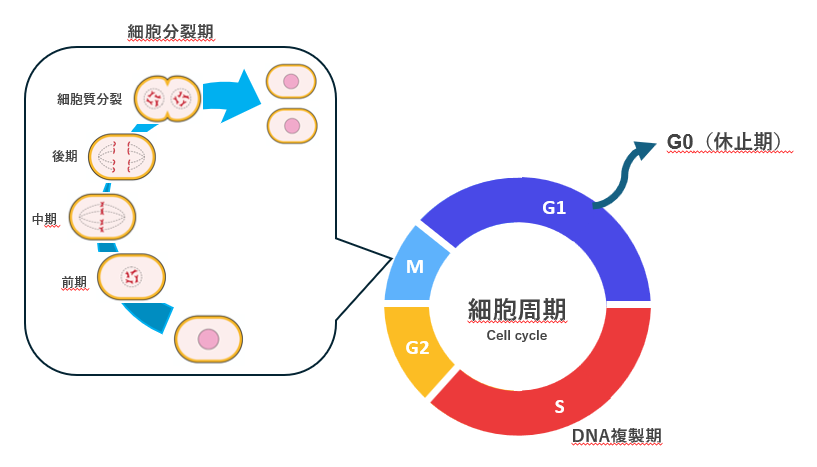
細胞が増殖するためには、「DNA複製」と「細胞分裂」が必須で、それらが交互に繰り返し、細胞周期に従って進行する。S期においてDNAを複製し、M期で細胞が分裂する(図1参照)。G1及びG2期は、その間期である。哺乳類細胞では、細胞周期はおよそ8〜30時間で1周するが、この所要時間は主にG1期とG2期の長さによって決まり、S期およびM期の長さは比較的一定である。一方、胚性幹細胞(embryonic stem cell: ES細胞)は、分化能(多能性)を維持するために、細胞周期を比較的速い速度で繰り返すことが知られている。特にG1期が短く、S期が比較的長い傾向があり、栄養状態や増殖因子などの環境シグナルに敏感に反応して細胞周期を調節する。このようにG1期が短縮されているのは、ES細胞が分化誘導シグナルに晒される時間を最小限に抑えることで、未分化状態を維持するためである。G1期は、通常の細胞において分化や運命決定のための外的シグナルに最も感受性の高い時期であるが、ES細胞ではこの期間を極端に短くすることで、分化を回避していると考えられている。また、S期が比較的長いのは、ゲノムの正確な複製や染色体の安定性を確保する必要性が高いためとされており、これも幹細胞の特性を保つうえで重要な役割を果たしている。
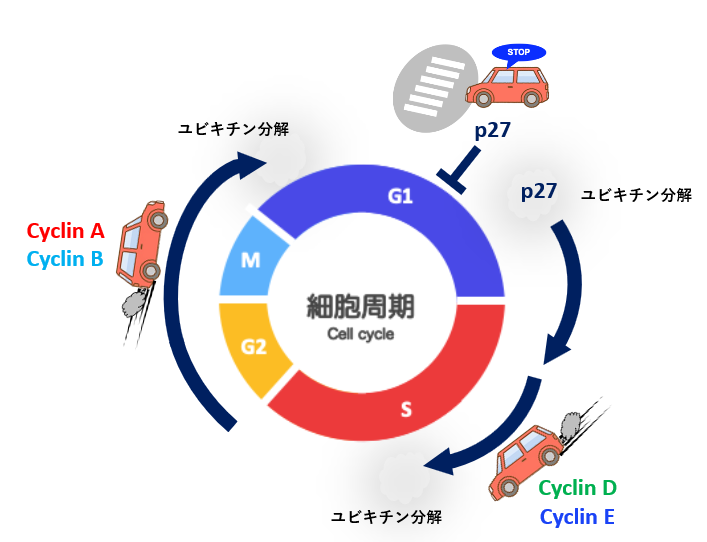
細胞周期の進行は、サイクリン/サイクリン依存性キナーゼ(Cyclin-dependent kinase: CDK)複合体によるRbタンパクなどの標的タンパク質のリン酸化によって制御されている1,2)。サイクリン/CDKの活性は、サイクリンの周期的なタンパク質分解によるタンパク質量の調節により制御され、UPSによるタンパク質分解が重要な役割を果たしている(図2)。細胞周期の調節には多くの因子が関与しており、複雑かつ精緻に制御されている。細胞周期がスムーズに回転するためには、いくつかのチェックポイントがあり、常に進行状態を監視している。G1期停止および休止期(G0期)に深く関わるp27Kip1は、CDKの働きを阻害する因子として知られ、増殖時にはユビキチン分解され、サイクリン/CDKが活性化する。細胞周期の回転は、CDKがエンジン、サイクリンがアクセル、CDK阻害因子がブレーキに例えられる(図2)。
UPS経路とE3リガーゼの役割
ユビキチン依存的タンパク質分解では、E1酵素(ユビキチン活性化酵素)によるユビキチンの活性化、E2酵素(ユビキチン結合酵素)によるユビキチンの受け渡し、そしてE3リガーゼ(ユビキチンリガーゼ)による基質タンパク質へのユビキチン付加(ポリユビキチン化)が順に行われる。ユビキチンは、76アミノ酸からなる小さなタンパク質で、ポリユビキチン化されたタンパク質は26Sプロテアソームにより分解される3)。E3リガーゼは基質特異性を決定する因子であり、その種類と調節は細胞周期の各段階に密接に関与している。
E3リガーゼは、HECT型およびRINGフィンガー型の2種類に大別され、さらにRING型には、単体で働くものと複合体を形成して働くものに分けられる。HECT型E3としては、ゲートキーパーとして知られているp53のユビキチンリガーゼであるE6-AP(E6-associated protein)が知られ、子宮頚癌の発症に関連する。一方、RING型E3には、単体で働く代表的なものとして、MDM2、c-Cbl、BRCA1、Parkinなどが知られている。特に、BRCA1は乳癌、Parkinはパーキンソン病に深く関与する。複合体を形成して働くものには、APC/C(Anaphase Promoting Complex/Cyclosome)やSCF(Skp1–Cul1–F-box)が知られ、細胞周期制御において重要な役割を果たす4,5)。APC/Cは、11から13のサブユニットからなるタンパク質複合体で、活性化因子であるCDC20あるいはCdh1を介して基質タンパク質に結合する。APC/CCDC20は分裂中期にいくつかの主要な基質タンパク質を標的とし、APC/CCdh1は有糸分裂の後半とG1期により広範囲の基質タンパク質を標的とする。また、SCFはF-boxタンパク質を介して基質タンパク質に結合し、ヒトでは約70種類存在することが知られている。F-boxは、タンパク質中にロイシンリッチリピートを持つFBXLファミリーやWDリピートを持つFBXWファミリー、その他のFBXOファミリーに分類される。SCFは、細胞周期制御のみならず、細胞遊走、DNA修復、細胞分化、アポトーシス、免疫応答など、様々な生命活動に関与している。細胞周期調節因子のユビキチン分解は、基質タンパク質ごとに時期を選んで行われる選択的なプロセスであり、細胞周期を適切に制御するうえで重要な仕組みである。このユビキチン分解は、細胞周期のさまざまなイベントに関与している6,7)。
細胞周期におけるユビキチン分解異常
細胞周期調節因子の分解異常は、増殖の異常を引き起こすだけでなく、分化や老化、幹細胞性維持にも影響を与える。増殖促進やがん化に関わる因子のユビキチン分解抑制によるタンパク質過剰発現や、逆に増殖やがん化を抑制する因子の過剰なユビキチン分解によるタンパク量の低下により、細胞周期調節の異常が起こり、がん化やがんの進展に関わることが知られている。例えば、SCFSkp2によるp27Kip1の過剰分解はがん細胞における無制御な細胞増殖を促進し8)、APC/CCdh1の不活性化はAurora-AキナーゼやAurora-Bキナーゼなどの分裂期因子の蓄積を引き起こし、染色体異常をもたらす9)。
最近の知見と今後の展望
ユビキチン分解は、単なる「掃除機構」ではなく、細胞の「時間」を精緻に設計する制御装置として機能し、細胞周期、炎症、がん化などに関わる多様なタンパク質の分解に重要な役割を果たしている。上述の通り、体細胞と多能性幹細胞では細胞周期の制御機構が大きく異なっている。興味深いことに、多能性幹細胞では細胞周期を通じてAPC/CCdh1の活性が抑制されている。最近、著者らは、APC/CCdh1の基質タンパク質の1つであるAurora-Bキナーゼが、体細胞ではM期に活性を持つのに対し、多能性幹細胞ではユビキチン分解を免れることで細胞周期を通じて安定的に活性化し、細胞分裂だけでなく未分化能の維持にも関与していることを明らかにした10)。今後、体細胞のみならず、多能性幹細胞におけるUPSを介した細胞周期制御のさらなる分子機構の解明が期待される。
また、細胞周期制御においては、時期特異的で正確なユビキチン分解が不可欠であり、その破綻ががんなどの疾病に結びつくことが明らかになりつつある。がんや幹細胞研究の分野では、UPSを標的とした分子標的薬の開発が進展しており、特に異常なE3リガーゼ活性を制御することで、細胞周期の破綻を是正する新たな治療アプローチとして注目されている。近年では、標的タンパク質を選択的にユビキチン化して分解へと導く新しい薬剤設計法である「PROTAC(Proteolysis Targeting Chimera)」が登場しており11)、従来の阻害薬では標的としにくかった「undruggable」な分子にも適用可能である。これにより、より精緻かつ持続的な治療介入が可能になると期待されている。
■参考文献
- Sherr CJ. G1 phase progression: cycling on cue. Cell 79, 515–555, 1994.
- Hunter T, Pines J. Cyclins and cancer II: cyclin D and CDK inhibitors come of age. Cell 79, 573–582, 1994.
- Hershko A, Ciechanover A. The ubiquitin system. Annu. Rev. Biochem. 67, 425–479, 1998.
- Guardavaccaro D, Pagano M. Stabilizers and destabilizers controlling cell cycle oscillators. Mol. Cell 22, 1–4, 2006.
- Peters JM. The anaphase promoting complex/cyclosome: a machine designed to destroy. Nat. Rev. Mol. Cell Biol. 7, 644–656, 2006.
- Nakayama KI, Nakayama K. Ubiquitin ligases: cell-cycle control and cancer. Nat. Rev. Cancer 6, 369–381, 2006.
- Pagano M. Role of the ubiquitin–proteasome pathway in the degradation of key regulators of the cell cycle. Cell Death Differ. 11, 1075–1085, 2004.
- Kudo Y, Kitajima S, Sato S, Miyauchi M, Ogawa I, Takata T. High expression of S-phase kinase-interacting protein 2, human F-box protein, correlates with poor prognosis in oral squamous cell carcinomas. Cancer Res. 61, 7044–7047, 2001.
- Engelbert D, Schnerch D, Baumgarten A, Wäsch R. The ubiquitin ligase APCCdh1 is required to maintain genome integrity in primary human cells. Oncogene 27, 907–917, 2008.
- Tsunematsu T, Mouri Y, Shao W, Arakaki R, Ruppert JG, Murano K, Ishimaru N, Guardavaccaro D, Pagano M, Kudo Y. Sustained chromosomal passenger complex activity preserves the pluripotency of human embryonic carcinoma cells. Sci. Signal.18, eadg4626, 2025.
- Vetma V, O’Connor S, Ciulli A. Development of PROTAC degrader drugs for cancer. Annu. Rev. Cancer Biol.9, 119–140, 2025.
■掲載論文のご紹介
題名:Sustained chromosomal passenger complex activity preserves the pluripotency of human embryonic carcinoma cells.
掲載誌:Science Signaling 18 巻874 号(DOI: 10.1126/scisignal.adg4626)
著者名:Takaaki Tsunematsu, Yasuhiro Mouri, Wenhua Shao, Rieko Arakaki, Jan G. Ruppert, Kensaku Murano, Naozumi Ishimaru, Daniele Guardavaccaro, Michele Pagano, Yasusei Kudo,
Abstract:
持続的な染色体パッセンジャー複合体活性がヒト胚性がん細胞の多能性を保持する。
染色体パッセンジャー複合体(chromosomal passenger complex; CPC)は、微小管結合タンパク質であるBorealin、Aurora-Bキナーゼ、CPC安定化因子のINCENP、およびアポトーシス抑制因子ファミリーのSurvivinから構成されており、細胞分裂を制御し、体細胞では有糸分裂中のみ活性を持つ。APC/CCdh1(anaphase-promoting complex/cyclosome-Cdh1)ユビキチンリガーゼ複合体は、細胞分裂後にAurora-BおよびBorealinの分解に関わる。著者らは、ヒト胚性がん(hEC)細胞では細胞周期を通じてAPC/CCdh1活性が低いため、Aurora-BおよびBorealinが安定して存在することを見出した。そのため、hEC細胞では体細胞とは異なり、CPC活性が細胞周期全体を通じて持続していた。APC/CCdh1の活性化によるAurora-BおよびBorealinの分解は、hEC細胞の自発的な分化を引き起こした。これらの知見は、APC/CCdh1活性に基づいてCPCがhEC細胞の未分化状態を維持する役割を担っていることを示している。
掲載元:Lab.First 研究ナレッジ

