岡本 一男 / Kazuo Okamoto
金沢大学がん進展制御研究所 免疫環境ダイナミクス研究分野・教授
金沢大学 新学術創成研究機構 免疫ネットワーク研究ユニット ユニットリーダー

1. 骨免疫学 / Osteoimmunology
骨は身体を支え円滑な運動を可能にする運動器であるとともに、カルシウムやリンといったミネラル代謝調節の中枢を担う器官である。一方、免疫系は外来異物を排除する生体防御システムであるため、一見すると骨とは無関係に思えるかもしれない。しかし実際には両者は様々な状況で相互に影響し合う。骨髄は造血幹細胞を維持し、多くの免疫細胞が分化する造血器官である。さらに骨代謝に関わる細胞と免疫細胞がサイトカインや受容体などの制御因子を共有しているため、両者が共存する環境では相互作用が生じ得る。骨代謝と免疫学の融合領域として「骨免疫学」は創成され、骨と免疫系の相互作用や共通機構に関する研究が精力的になされてきた。
1-1. 破骨細胞とRANKL〜骨と免疫系の共通点〜
骨は主に三つの骨代謝細胞―破骨細胞、骨芽細胞、骨細胞―によって制御される。破骨細胞は細胞融合して分化した強大な多核細胞であり、酸とタンパク質分解酵素を放出して骨を吸収する。一方、骨芽細胞はコラーゲンなどの骨基質タンパク質を合成・分泌し、リン酸カルシウム結晶の沈着を介して骨を形成する。骨細胞は骨芽細胞の最終分化形態であり骨組織に埋没し、多数の細胞突起を張り巡らして細胞間ネットワークを作り出し、力学的刺激を感知して骨吸収と骨形成を制御する。その堅固な性状ゆえに、骨は一見静的な構造体として捉えられがちだが、実際は老朽化した古い組織が破骨細胞により分解され、骨芽細胞により新たな骨が構築されるという、動的なプロセスにより構造と機能が保持される。この再構築過程を骨リモデリングと呼び、そのバランスの破綻は様々な骨疾患の要因となる。
骨芽細胞は間葉系に属するが、破骨細胞は単球/マクロファージ系前駆細胞を由来とし、いわば血球系細胞に属する。破骨細胞の分化にはサイトイカンRANKLの刺激を必要とする。RANKLは骨芽細胞や骨細胞などの間葉系支持細胞が産生し、破骨細胞前駆細胞上の受容体RANKに結合し刺激することで、細胞融合を伴う特徴的な分化過程を経て成熟破骨細胞になる1。RANKの下流ではTRAF6を介してNF-κBやMAPK、c-Fosの活性化が誘導され、破骨細胞分化の中心的役割を担うマスター転写因子NFATc1が発現誘導される。NFATc1はT細胞活性化に重要な転写因子であるが、破骨細胞では細胞形態や細胞融合、骨吸収能など破骨細胞に特徴的な遺伝子群の発現を統括している。またDAP12とFcRγに会合する免疫グロブリン様受容体からのシグナルがRANKシグナルに対する共刺激として働き、NFATc1の誘導と活性化に必須のカルシウムシグナルが惹起される。上記の破骨細胞分化機構が解明された当時、NFATc1、DAP12、FcRγなどは免疫細胞での機能がよく知られていた分子であった。破骨細胞が単球/マクロファージ系前駆細胞由来であることを考えたら今では大した驚きはないかもしれないが、まだ学際研究の風潮が乏しかった当時、こうした骨と免疫の共通点は意外性をもって受け入れられ、その融合研究の重要性を後押ししたとも言える。
RANKLは1998年に破骨細胞分化の必須因子として報告されたが、実はその前年に、T細胞で発現する新規TNFファミリーサイトカインとして免疫学分野で同定されていたという経緯がある。さらにRANKLは胸腺髄質上皮細胞の分化、リンパ節の形成、腸管M細胞の分化にも必須である1。今ではRANKLに限らず様々なサイトカイン、ケモカインなどの調節因子を骨代謝細胞と免疫細胞が共有していることがわかり、多様な相互作用が明らかとなっている。
1-2. 免疫系による骨の制御: 骨と免疫の相互作用が生み出す病態
骨と免疫系の密接な関係性が故、異常な免疫系の活性化は骨にも影響が波及してしまう。その典型例が関節リウマチ(rheumatoid arthritis: RA)である。RAでは自己免疫性の滑膜炎症により関節局所の骨・軟骨破壊が起こる。RAの炎症滑膜では、IL-17産生性ヘルパーT細胞サブセットであるTh17細胞がTNFやIL-6などのサイトカイン産生を誘導し局所炎症を促す。こうした炎症性サイトカインに加え、Th17細胞自身が産生するIL-17も、滑膜線維芽細胞を刺激してRANKL発現を誘導する2。RA滑膜の滑膜線維芽細胞は、極めて不均一性が高いことが近年のシングルセル解析により明らかにされ、特にRANKLやMatrix metalloproteinase (MMP)を発現する滑膜線維芽細胞は滑膜表層に位置し、IL-6などの発現を特徴とする炎症型線維芽細胞とは性質を異にする。組織破壊型とも言われる前者の滑膜線維芽細胞は転写因子ETS1が細胞運命決定を担い、RANKL及びMMPの遺伝子発現を制御している3, 4。一方、炎症型線維芽細胞はTNFやNOTCHシグナルなどが分化を規定する。最近、炎症収束を促すCD200陽性滑膜線維芽細胞集団も報告されている。また免疫複合体は直接破骨細胞に作用して分化を促す。非シアル化抗体が高い破骨細胞分化促進効果を示すが、シアル酸修飾もTh17細胞によって制御されており、Th17細胞は骨吸収を推し進める要素を多く持っている5。さらにTNFの作用によりWntシグナルが阻害され、骨形成が抑制される6。以上のように、リンパ球、滑膜線維芽細胞、破骨細胞、骨芽細胞といった免疫と骨の複雑な細胞間ネットワークが炎症滑膜という微小環境内で築かれている(図1)。
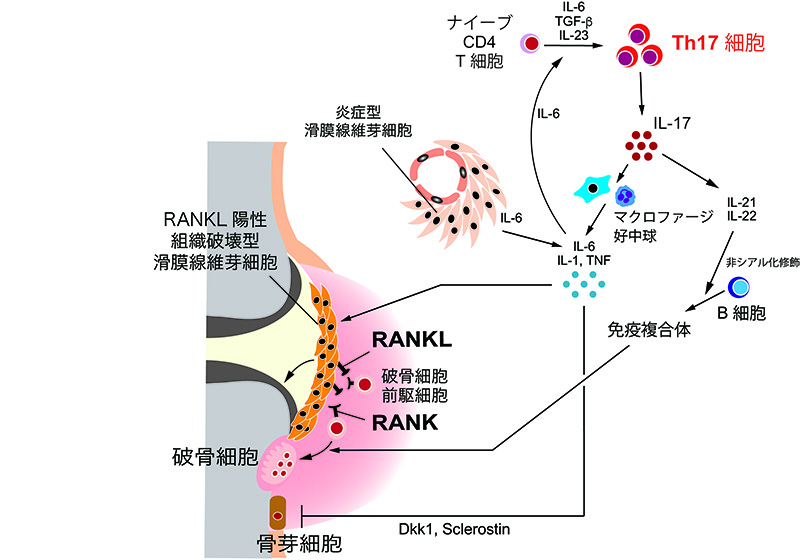
RAに限らず、様々な病的状況にて免疫細胞は骨に影響を及ぼす。歯周炎に伴う歯槽骨破壊では口腔細菌応答性のTh17細胞や好中球によるRANKL発現誘導が関与しており7, 8、炎症性骨破壊にはIL-17を主軸とした破骨細胞活性化経路が根付いている。また骨折時には、IL-17産生性γδT細胞が骨損傷組織に集積する間葉系幹細胞に直接作用することで、細胞増殖と骨芽細胞分化を誘導し骨再生を進める9。脊椎関節炎ではγδT細胞やiNKT細胞、自然リンパ球によるIL-17産生の重要性を指摘されている。さらに変形性関節症でもTh17細胞やγδT細胞が産生するIL-17と関節軟骨の老化との関わりが報告されている10。最近では変形性関節症滑膜の血管周囲に存在するCD34hiCD70hi線維芽細胞集団が炎症抑制と線維化進行に寄与することが報告された11。Th1細胞の主要サイトカインであるIFN-γは、破骨細胞分化の強力な阻害因子である12。IFN-γシグナル異常が原因のメンデル遺伝型マイコバクテリア易感染症患者では、破骨細胞の過剰な活性化が多発性骨髄炎発症に繋がると考えられている13。骨代謝に作用する免疫細胞・因子は枚挙にいとまがないが、感染や自己免疫などに関わる様々な免疫細胞・因子は骨代謝に対して異なるアウトプットを生み出し、骨疾患の病態を築く(図2)。
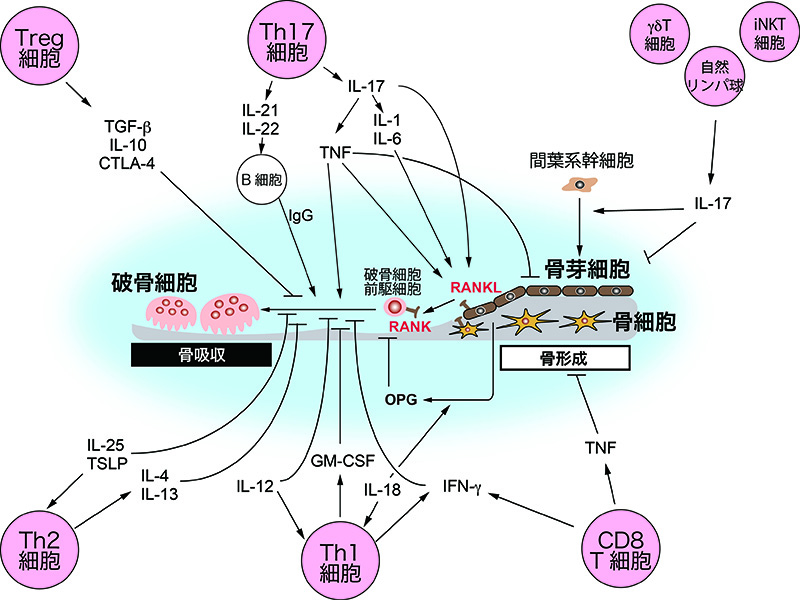
骨代謝に影響を与えるサイトカインの例として、各種T細胞サブセットに関連するサイトカインと、それらの破骨細胞および骨芽細胞に与える効果を示した。
1-3. 骨による免疫制御: 骨髄における造血制御
ヒトでは出生後、全ての血球細胞は骨髄の造血幹細胞から産生される。CXCL12-abundant reticular (CAR)細胞とも呼ばれるCXCL12+LepR+間葉系幹細胞が、造血幹細胞の維持に必要なサイトカインSCFとCXCL12の産生源であり、造血幹細胞ニッチとして機能する14。また骨芽細胞はIL-7やDLL4を産生することで、骨髄の共通リンパ球前駆細胞の維持に働く他15、細胞外ATP産生によりプラズマ細胞の維持にも関わる16。さらに骨細胞由来のIL-19が好中球分化に関与するという報告もある。このように骨髄では多様な間葉系細胞の協働により、造血幹細胞や免疫細胞の維持・分化が制御されている。
一方、間葉系幹細胞や骨芽細胞の病的変化は様々な形で造血系に影響が及ぶ。たとえば敗血症ではG-CSF増加により骨髄の骨芽細胞が消失し、その結果共通リンパ球前駆細胞が減少してリンパ球減少症が起こる15。また、骨芽細胞や骨芽細胞前駆細胞におけるβ-カテニン活性化やSHP2の活性型変異、Sbds遺伝子の発現低下などは骨髄性白血病を齎す17。さらに肺がん由来の可溶性終末糖化産物受容体が骨芽細胞に遠隔的に作用し、腫瘍促進性の好中球の生成を促すことや、皮膚がんが骨芽細胞・骨細胞に遠隔的に働いて、免疫抑制型マクロファージを誘導することなど、がん細胞が骨髄環境に働きかけることでがんの悪性化を引き起こす経路も報告されている4。
加齢に伴う骨環境の変化と免疫系との関わりも指摘されている。造血系は加齢に伴いミエロイド系分化に偏る傾向が知られている。この変化の背景には、骨格幹細胞の老化や、骨内膜の骨芽細胞前駆細胞および血管内皮からのIL-1産生増加による骨髄環境変化が関与している。また運動や摂食など日常活動と骨髄の骨免疫環境の関係性も報告されている。運動負荷は骨髄マクロファージを介した骨髄脂肪の低下に繋がり、それに伴い骨形成とリンパ球産生が亢進する。また運動により脂肪組織でのレプチン産生が低下すると、骨髄間葉系幹細胞のCXCL12発現が高まり、その結果造血幹細胞を静止期に留め、炎症性白血球の出現が抑えられる。断食は骨髄のCXCL13産生を亢進させナイーブB細胞の骨髄遊走を誘導したり、骨髄の記憶T細胞が増加すること等も報告されている4。
後編:オステオネットワーク~骨を中心とした多臓器制御ネットワーク~ に続く
■参考文献
- 1. Okamoto, K. et al. Osteoimmunology: The Conceptual Framework Unifying the Immune and Skeletal Systems. Physiological reviews 97,1295-1349 (2017).
- 2. Sato, K. et al. Th17 functions as an osteoclastogenic helper T cell subset that links T cell activation and bone destruction. J Exp Med 203,2673-2682 (2006).
- 3. Yan, M. et al. ETS1 governs pathological tissue-remodeling programs in disease-associated fibroblasts. Nat Immunol 23,1330-1341 (2022).
- 4. Okamoto, K. Crosstalk between bone and the immune system. J Bone Miner Metab 42,470-480 (2024).
- 5. Pfeifle, R. et al. Regulation of autoantibody activity by the IL-23-TH17 axis determines the onset of autoimmune disease. Nature immunology 18,104-113 (2017).
- 6. Diarra, D. et al. Dickkopf-1 is a master regulator of joint remodeling. Nat Med 13,156-163 (2007).
- 7. Tsukasaki, M. et al. Host defense against oral microbiota by bone-damaging T cells. Nature communications 9,701 (2018).
- 8. Ando, Y. et al. The neutrophil-osteogenic cell axis promotes bone destruction in periodontitis. Int J Oral Sci 16,18 (2024).
- 9. Ono, T. et al. IL-17-producing γδ T cells enhance bone regeneration. Nature communications 7,10928 (2016).
- 10. Faust, H.J. et al. IL-17 and immunologically induced senescence regulate response to injury in osteoarthritis. J Clin Invest 130,5493-5507 (2020).
- 11. Miyahara, J. et al. CD34hi subset of synovial fibroblasts contributes to fibrotic phenotype of human knee osteoarthritis. JCI Insight 10 (2025).
- 12. Takayanagi, H. et al. T-cell-mediated regulation of osteoclastogenesis by signalling cross-talk between RANKL and IFN-γ. Nature 408,600-605 (2000).
- 13. Tsumura, M. et al. Enhanced osteoclastogenesis in patients with MSMD due to impaired response to IFN-gamma. J Allergy Clin Immunol 149,252-261 e256 (2022).
- 14. Sugiyama, T., Omatsu, Y. & Nagasawa, T. Niches for hematopoietic stem cells and immune cell progenitors. International immunology (2018).
- 15. Terashima, A. et al. Sepsis-Induced Osteoblast Ablation Causes Immunodeficiency. Immunity 44,1434-1443 (2016).
- 16. Ishikawa, M. et al. Bone marrow plasma cells require P2RX4 to sense extracellular ATP. Nature 626,1102-1107 (2024).
- 17. Zambetti, N.A. et al. Mesenchymal Inflammation Drives Genotoxic Stress in Hematopoietic Stem Cells and Predicts Disease Evolution in Human Pre-leukemia. Cell Stem Cell19,613-627 (2016).
関連情報
特集:骨代謝研究
コスモ・バイオ(株)が取り扱う、骨代謝研究用試薬のご紹介です。
掲載元:Lab.First 研究ナレッジ

