CYTOSKELETON NEWS – February 2023 |Dysfunctional Lysosomes Contribute To Lipid Droplet Accumulation In Fatty liver disease
血管が豊富に発達した肝臓は、血液の解毒において極めて重要な役割を果たし、小腸内の脂肪の分解にも関与しています。Hepatocytesと呼ばれる肝細胞そのものが、コレステロール合成、脂肪生成、トリグリセリド生成など、数多くの生化学的機能を担っています。 脂肪酸代謝の欠陥は、肝臓に過剰な脂肪が蓄積する病気である脂肪性肝疾患(FLD)につながる可能性があります1。脂肪性肝疾患を早期に診断し治療しないと、肝臓の内部に一連の構造変化が発生します。FLDの最初の段階では、肝細胞の脂質滴に沈着する脂質が増加します。脂質滴は成長、拡大、蓄積し、肝臓を肥大化させます。その結果、瘢痕組織が形成され、さらに線維化が進みます。その結果、瘢痕組織は肝臓を硬くし、肝硬変を引き起こし、最終的には肝不全に至ります。 以下、脂質滴下とFLDにおけるその重要な役割、そしてFLDにおけるリソソームの役割に関する最近の注目事項について説明します。
脂肪滴による脂質の蓄積
脂肪滴は、ほとんどの細胞内で見られる小さな球状の構造で、トリアシルグリセリドなどの中性脂質の核をリン脂質の単層が取り囲んだ構造をしており、体内の脂肪の貯蔵と代謝において重要な役割を担っています。肝臓では、脂質滴は脂肪の合成、貯蔵、分解に重要な役割を果たしています。正常な状態では、肝臓はトリアシルグリセリドを合成して貯蔵し、絶食時や体がエネルギーを必要とするときに血流に放出されます2。
健康な肝臓では、常に脂質の出入りが維持されています。脂質は、脂肪酸輸送体CD36、FATP2、FATP5を介した循環脂質の取り込みにより獲得されます2,3。さらに、SREBP1cとChREBPを介した肝細胞内のde novo脂肪生成により脂質が生成されることもあります。その後、脂質は主にミトコンドリアで酸化され、一部はペルオキシソームやシトクロムで処理されます。さらに、脂質は超低密度リポタンパク質(VLDL)として肝臓から排出され、他の組織で使用されることもあります。脂質の輸出はMTTPとapoB100によって制御されています3。 脂質の輸入、脂質生成、脂質代謝、脂質輸出という4つのメカニズムは、健康な脂質レベルを維持するために肝細胞内でしっかりと制御されています。
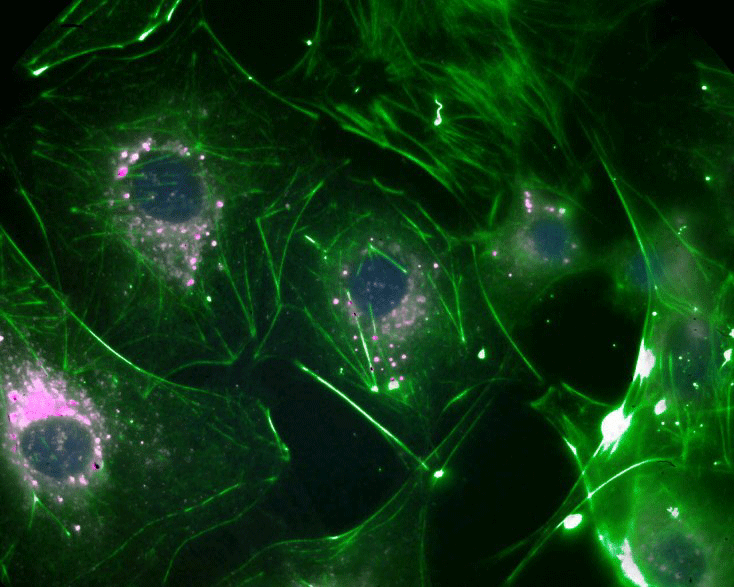
LipiBright™ SMCy3.5(ピンク)、アクチン細胞骨格染色(緑、SiR-Actin)、DNAプローブ(青、SPY505-DNA)で標識した生きたSwiss3T3細胞の広視野蛍光イメージングです。
FLDの最初の段階では、脂質代謝の機能不全があり、脂質が脂肪滴に蓄積されます。FLDの発症には、前述のメカニズムの調節不全が一因となっています。FLDでは、膜貫通タンパク質であるCD36、FATP2、FATP5の増加が循環脂質の取り込みを促進します4。同様に、SREBP1Cの増加がしばしば見られ、それによりde novo脂肪生成と肝脂質レベルが増加します5。また、ミトコンドリアの欠損により、脂質代謝の機能不全が生じ、シトクロムやペルオキシソームの脂質酸化が増加するケースもあります6。これにより、酸化ストレスを促進し細胞障害を引き起こす活性酸素種(ROS)レベルが上昇します。さらに、MTTPとapoB100の減少により、VLDLの排出量が減少します6。 これらの経路の調節不全の結果として、脂質は肝細胞内に脂質滴として蓄積されます。この悪循環の中で、活性酸素による酸化ストレスがさらに発生し、肝障害がさらに進行し、FLDから肝硬変に移行していきます。
リソソームによる脂肪滴の調節
リソソームは膜に結合した球形の細胞小器官で、さまざまな生体分子の代謝に関与する加水分解酵素を含んでいます。リソソーム内腔には 60 を超える酵素があり、リソソームはペプチド、核酸、炭水化物、脂質などのほとんどの生体分子を分解することができます。生体分子の分解に加えて、リソソームはオートファジー、栄養素の感知、シグナル伝達、および遺伝子制御にも関与しています。これにより、リソソームはさまざまなレベルで代謝を調節できるようになります9。
肝臓では、リソソームが脂質を分解し、分解産物をミトコンドリアとペルオキシソームに送って酸化させます10。さらに、分解産物はmTOR経路の活性化を調節します11。mTOR経路は、脂質代謝の調節において重要な役割を果たすシグナル伝達経路です 。リソソーム分解産物によって刺激されると、脂質生成酵素の活性化によって脂質生成が促進され、リソソーム機能を抑制することによって脂質代謝が阻害されます12。したがって、リソソーム – mTOR 軸は、肝細胞内の脂質の同化と異化の両方を調節するサイクルを作成します。FLD の間、脂質レベルの上昇は mTOR 経路を刺激し、脂質生成を悪化させ、リソソーム脂質代謝を低下させます 13。これにより、リソソーム内での脂質の蓄積をもたらす悪循環が生じ、リソソームによる脂肪滴のオートファジーターンオーバーの機能不全につながり、肝臓の脂肪化を悪化させます14。
さらに、脂肪滴色素を使用すると、脂肪滴がリソソームと相互作用することが明らかになりました15。 健康な細胞では、遊離脂肪酸が脂肪滴から細胞質に輸送されて代謝されることにより、脂肪滴は徐々に分解されます。脂肪滴が分解されると、脂肪滴をリソソームに輸送して完全に分解するオートファゴソームに飲み込まれるほど小さくなります。このように、リソソームは肝臓内の過剰な脂肪滴の分解と除去において重要な役割を果たします。しかし、FLD 患者では、リソソームが脂肪酸と脂肪滴で過剰になり、効果的に脂肪滴を分解して除去することができなくなることから、脂肪滴-オートファゴソーム-リソソーム軸が脂肪肝疾患に寄与していることが示唆されています16。
脂肪肝疾患中の脂肪滴蓄積におけるリソソームの関与に関するこれらの最近の発見により、リソソームは脂肪肝疾患を治療または予防するための潜在的な新たなターゲットとして注目されています。mTOR 経路を阻害すると、リソソームの正常な機能が回復し、オートファジーが回復します。
おわりに
脂肪肝疾患は、発症のメカニズムが比較的明確な疾患です。脂質代謝の経路は高度に制御されており、相互に関連しています。これらの経路のいずれかで不均衡が生じると、脂質の異化作用と同化作用が大きく変化し、肝細胞内での脂質の蓄積が引き起こされる可能性があります。リソソームの老廃物は、脂質の同化作用と異化作用の両方の重要な調節因子である mTOR 経路を刺激します。さらに、リソソームは遊離脂肪酸を代謝することによって脂肪滴を分解し、脂肪滴のサイズを小さくします。 脂質代謝に対するリソソームの寄与は長い間十分に研究されていませんでした。しかし、最近の研究結果では、それらが FLD の発症に重要な役割を果たしており、将来的には新しい治療標的として役立つ可能性があることが示唆されています。
■参考文献
- Singh, S., Osna, N. A. & Kharbanda, K. K. Treatment options for alcoholic and non-alcoholic fatty liver disease : A review. 23, 6549–6570 (2017).
- David Højland Ipsen, Jens Lykkesfeldt, and P. T.-N. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cell mol life Sci. (2018).
- G.Mashek, D. Hepatic lipid droplets: A balancing act between energy storage and metabolic dysfunction in NAFLD. Mol. Metab. (2021).
- Debby P.Y. Koonen., J. R. B. D. Increased expression of CD36, FATP2 and FATP5 in the liver of obese and type 2 diabetic mice: its role in lipid metabolism. Diabetes 56, 2863–2871 (2007).
- Tarling, E. SREBP-1C: a key transcriptional regulator of lipid metabolism. Biochem. Soc. Trans. 32, 107–109 (2004).
- Koves, T.R., Ussher, J.R., & Muoio, D. M. Mitochondrial overload and incomplete fatty acid oxidation contribute to skeletal muscle insulin resistance. Cell Metab. 7, 45–56 (2008).
- Yuting Diao, Juan Tang, Xuerong Wang, Wei Deng, Jing Tang, C. Y. Metabolic Syndrome, Nonalcoholic Fatty Liver Disease, and Chronic Hepatitis B: A Narrative Review. Infect dis ther (2022).
- Min Yao, Wenjie Zheng, Li Wang, Miao Fang, Z. D. and D. Y. Novel Mechanism of Nonalcoholic Lipid Accumulation Promoting Malignant Transformation of Hepatocytes. Neoplasm (2018).
- Settembre, C., Fraldi, A., Medina, D. L., Ballabio, A. & Children, T. Signals for the lysosome: a control center for cellular clearance and energy metabolism. 14, 283–296 (2015).
- Carmine Settembre., A. B. Lysosome: regulator of lipid degradation pathways. Trends Cell Biol. 24, 743–750 (2014).
- Puertollano, R. mTOR and lysosome regulation. F1000Prime Rep. 6, (2014).
- Dudley W. Lamming., D. M. S. A central role for mTOR in lipid homeostasis. Cell Metab. 18, (2013).
- Meenu Rohini Rajan., P. S. Systems-wide Experimental and Modeling Analysis of Insulin Signaling through Forkhead Box Protein O1 (FOXO1) in Human Adipocytes, Normally and in Type 2 Diabetes. J. Biol. Chem. 30, (2016).
- Jing Pu. Targeting the lysosome: Mechanisms and treatmentsfor nonalcoholic fatty liver disease. J. Cell. Biochem. (2022).
- Ryan J. Schulze., M. A. M. Direct lysosome-based autophagy of lipid droplets in hepatocytes. PNAS (2020).
- Lars E. Larsen et al. Defective Lipid Droplet–Lysosome Interaction Causes Fatty Liver Disease as Evidenced by Human Mutations in TMEM199 and CCDC115. Cell Mol gastroenterol hepatol (2022).
関連情報
LipiBright™ 脂肪滴染色用 蛍光プローブ
MemGlow™ NR Membrane Polarity プローブ
Spirochrome プローブキット(SiR-Lysosome / SiR700-Lysosome)
MemGlow™ Fluorogenic Plasma Membrane Probes
Cytoskeleton(サイトスケルトン)社 CYTOSKELETON NEWS
※コスモ・バイオのホームページ上にあるCYTOSKELETON NEWSの特集ページです。
掲載元:Cytoskeleton News 2023年2月号


