CYTOSKELETON NEWS – January 2023 |Motor Control:How kinesins Drive Mitosis
細胞骨格の主要な構成要素のひとつである微小管(MT)は、a-とb-チューブリンタンパク質のヘテロダイマーで構成されています。チューブリンはMTの両端で異なる速度で重合することができ、プラス端ではより速く、マイナス端ではより遅く重合します。分子モーターであるキネシンとダイニンは、動的不安定性と呼ばれるMTの成長と収縮の動的挙動を制御することにより、MTの長さに関与しています1。これらのモーターは、MTに沿って働き、小器官の輸送、小胞の輸送、減数分裂、有糸分裂などの細胞機能を担っています。
キネシンは1985年に発見され、イカや脊椎動物の脳の軸索に沿って微小管を循環させ、オルガネラを移動させる新しいクラスのATPaseであることが確認されました2,3。それ以来、ヒトでは45種類のキネシンが同定されており、キネシンスーパーファミリー(KIF)は14種類のキネシンファミリーに分類されています4。ほとんどのキネシンはプラス端指向性の運動をしますが、キネシン14サブファミリーのモーターはC末端にモーターを持ち、マイナス端指向性です。キネシンの一般的な構造は、3つのドメインからなっており
1) ATPを加水分解し、微小管に結合する、各キネシンファミリー内でよく保存されている触媒モーターまたはヘッドドメイン
2) 隣接するネックドメインはコイルドコイル相互作用に関与し、モーターを高次オリゴマーに組織化できる
3) 反対側の端には、キネシンファミリー内で非常に分岐し、時にはカーゴタンパク質やDNA、制御ドメインとの相互作用に用いられるテールドメインがあります5-8。
以下では、キネシンが有糸分裂の各段階において、紡錘体の形成や染色体の構成にどのような影響を与えるかについて、最近の知見を紹介します9。
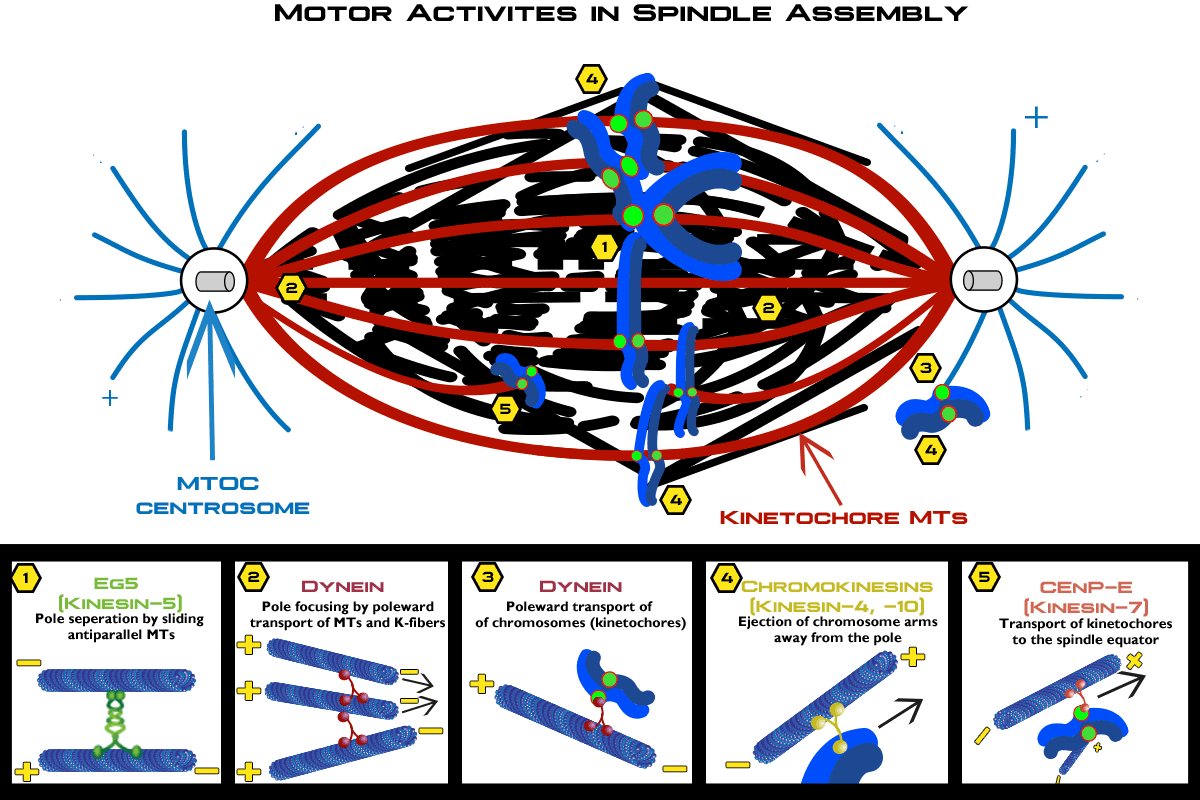
図1 有糸分裂時の双極紡錘体形成の模式図。微小管とモータータンパク質は、動原体の配向と染色体の移動に重要な役割を果たす。
有糸分裂におけるキネシンの役割
体細胞では細胞分裂の際に、親細胞の各染色体のコピーが2つの娘細胞に分離される有糸分裂が起きます。有糸分裂には、(前期)プロフェーズ、(前中期)プロメタフェーズ、(中期)メタフェーズ、(後期)アナフェーズ、(終期)テロフェーズの5つの段階があります。
前期では複製された中心体が核の反対側に移動します。ここでは、MTが重なり合い、互いに反平行に向かいます。キネシン5サブファミリーに属するKIF11モーター(別名Eg5)は、MTに架橋することができ、MTの外へのスライドを促進し、中心体を押し広げるのに役割を果たします(図1)10,11。また、ダイニンはMTを細胞皮質や核膜に繋ぎ止めることで、中心体の移動を助けています。
前中期では双極性の有糸分裂紡錘体を作り、染色体とMTの相互作用を形成し、紡錘体赤道への染色体集束を促進することを目標にします。紡錘体の自己組織化には、KIF11、KIF15、KIFC1が反対方向のモーター作用を行い、中心体の分離を高め、紡錘体の長さを維持することが必要になります10。核膜が破壊されると、紡錘体のMTプラス端はキネトコアと呼ばれる高分子タンパク質複合体にアクセスすることができるようになります。キネトコアと結合するプラス端MTは、キネトコア微小管(kMT)と呼ばれるようになります。キネトコア内のすべてのkMT(通常10-30個)の集合体がキネトコアファイバー(K-fiber)12を構成し、その反対側では、KIFC1とダイニンのマイナス端指向性モーターがMTのマイナス端を中心体に固定し、集束した双極紡錘体極を形成します13。紡錘体赤道への染色体の収縮は、ダイニンおよびキネシン-7サブファミリーのKIF10モーター(別名CENP-E)によって助けられ、キネトコアの横方向のスライドを促進します(図1)14。染色体が適切に整列するためには、キネシンモーターであるKIF10、KIF18A、KIF2B、KIF2Cなどによってキネトコアを媒介する押し引き力を発生させる必要があります15-18。次に、紡錘体極から紡錘体赤道に向かって染色体を移動させるための力を発生させる必要があります。この機械的な力は極性放出力と呼ばれますが、これらの力が染色体会合にどの程度寄与しているかについては、さらなる研究が必要です19,20。キネシン-10サブファミリーのクロモキネシンKIF22(別名KID)とキネシン-4サブファミリーのKIF4は、有糸分裂中に染色体と相互作用し、染色体を極から押し出すMT力の生成に関わるモーターであると考えられています(図1)20,21。HeLa細胞においてKIF22をRNA干渉により欠失させると、染色体の位置がずれ、紡錘体の長さに異常が生じ、KIF4を欠損させると、染色体の乱れが生じました22,23。これらのモーターは、前中期および中期における染色体の移動に重要な役割を担っています。
細胞分裂後期には、姉妹染色分体は紡錘体の赤道に沿って並び続け、メタフェースプレート(赤道板)を形成する必要があります。この姉妹染色分体の整列と分離を同期して行うのは、多くの因子を必要とする複雑なプロセスです。キネシン13は、中心体において微小管のマイナス端に局在し、微小管の解重合を促し、染色体を極方向に引っ張る力を発生させます10,24。KIF18Aはまた、メタフェースプレートの適切な位置合わせとアナフェースのタイムリーな開始にも必須です25。また、KIF18AとKIF10は、MTが脱重合する際にキネトコアへの接着を維持する役割も担っています10,14,26。
キネシンを標的とした薬物療法
有糸分裂阻害薬は、がん治療薬として大きな関心を集めています。例えば、パクリタキセル(タキソール)は、MTを標的として細胞分裂を阻害する抗有糸分裂薬で、がん治療薬として使用されていますが、正常な分裂細胞にも影響を与えるため、深刻な副作用を持つことが知られています。がんにおいて制御異常を起こす可能性のあるこのモータータンパク質を標的としたキネシン阻害剤の候補をスクリーニングすることは、チューブリン系薬剤に代わる選択肢を提示するものです。化合物スクリーニングにより、KIF11を含むキネシンを阻害するリード化合物が同定され、これらは第II相臨床試験に移行してます29。しかしながら、現時点では、ほとんどの薬剤試験は有効性が乏しく、副作用の可能性もあるため、期待された結果はまだ得られておりません30。一方で、染色体不安定性(CIN)を有するがん細胞の生存能力は、染色体のアライメントを維持するKIF18Aの能力に依存していることから、KIF18A等の他のモーターは、新しい薬剤ターゲットとなる可能性があるとして、注目されています31。がん細胞の染色体アライメントに不可欠なモーターをCINのターゲットとすることは、がん細胞の抗有糸分裂療法に対してより脆弱にし、正常細胞に対しては最小限の作用しかもたらさない可能性があります32。
おわりに
今回のニュースレターでは、有糸分裂におけるキネシンの複雑な機構的役割を垣間見ることができます。他のタンパク質、微小管関連タンパク質、紡錘体のMTなども、細胞分裂において重要な役割を担っています。今後、モーターが互いに協調して、有糸分裂のさまざまな段階でMTを方向付け、染色体を整列させて細胞内を移動する力を生み出す仕組みについてさらなる研究が必要です。Cytoskeleton社では、この分野で多くの創薬活動を支援してきました33,34。キネシンの理解を深めていくことで、がん治療の有望なターゲットの発見となる可能性があります。
■参考文献
- Bringmann, H. et al. A Kinesin-like Motor Inhibits Microtubule Dynamic Instability. Science 303, 1519–1522 (2004).
- Vale, R. D., Reese, T. S. & Sheetz, M. P. Identification of a novel force-generating protein, kinesin, involved in microtubule-based motility. Cell 42, 39–50 (1985).
- Brady, S. T. A novel brain ATPase with properties expected for the fast axonal transport motor. Nature 317, 73–75 (1985).
- Lawrence, C. J. et al. A standardized kinesin nomenclature. J Cell Biology 167, 19–22 (2004).
- Wang, W., Cao, L., Wang, C., Gigant, B. & Knossow, M. Kinesin, 30 years later: Recent insights from structural studies: Kinesin, 30 Years Later: Structural Insights. Protein Sci 24, 1047–1056 (2015).
- Cochran, J. Kinesin Motor Enzymology: Chemistry, Structure, and Physics of Nanoscale Molecular Machines. Biophysical Rev 7, 269–299 (2015).
- Cason, S. E. & Holzbaur, E. L. F. Selective motor activation in organelle transport along axons. Nat Rev Mol Cell Bio 23, 699–714 (2022).
- Miki, H., Okada, Y. & Hirokawa, N. Analysis of the kinesin superfamily: insights into structure and function. Trends Cell Biol 15, 467–476 (2005).
- Dumont, S. & Mitchison, T. J. Force and Length in the Mitotic Spindle. Curr Biol 19, R749–R761 (2009).
- Cross, R. A. & McAinsh, A. Prime movers: the mechanochemistry of mitotic kinesins. Nat Rev Mol Cell Bio 15, 257–271 (2014).
- Tanenbaum, M. E. & Medema, R. H. Mechanisms of Centrosome Separation and Bipolar Spindle Assembly. Dev Cell 19, 797–806 (2010).
- Conway, W. et al. Self-organization of kinetochore-fibers in human mitotic spindles. Elife 11, e75458 (2022).
- Merdes, A. & Cleveland, D. W. Pathways of Spindle Pole Formation: Different Mechanisms; Conserved Components. J Cell Biology 138, 953–956 (1997).
- Gardner, M. K. CENP-E hangs on at dynamic microtubule ends. Nat Cell Biol 15, 1030–1032 (2013).
- Mayr, M. I. et al. The Human Kinesin Kif18A Is a Motile Microtubule Depolymerase Essential for Chromosome Congression. Curr Biol 17, 488–498 (2007).
- Stumpff, J., Dassow, G. von, Wagenbach, M., Asbury, C. & Wordeman, L. The Kinesin-8 Motor Kif18A Suppresses Kinetochore Movements to Control Mitotic Chromosome Alignment. Dev Cell 14, 252–262 (2008).
- Zhu, C. et al. Functional Analysis of Human Microtubule-based Motor Proteins, the Kinesins and Dyneins, in Mitosis/Cytokinesis Using RNA Interference. Mol Biol Cell 16, 3187–3199 (2005).
- Czechanski, A. et al. Kif18a is specifically required for mitotic progression during germ line development. Dev Biol 402, 253–262 (2015).
- Brouhard, G. J. & Hunt, A. J. Microtubule movements on the arms of mitotic chromosomes: Polar ejection forces quantified in vitro. Proc National Acad Sci 102, 13903–13908 (2005).
- Vukušić, K. & Tolić, I. M. Polar Chromosomes—Challenges of a Risky Path. Cells 11, 1531 (2022).
- Almeida, A. C. & Maiato, H. Chromokinesins. Curr Biol 28, R1131–R1135 (2018).
- Tokai-Nishizumi, N., Ohsugi, M., Suzuki, E. & Yamamoto, T. The Chromokinesin Kid Is Required for Maintenance of Proper Metaphase Spindle Size. Mol Biol Cell 16, 5455–5463 (2005).
- Short, B. KIF4 helps mitotic chromosomes get in shape. J Cell Biol 199, 715–715 (2012).
- Diez, S. Multi-talented MCAK: Microtubule depolymerizer with a strong grip. Nat Cell Biol 13, 738–740 (2011).
- Orr, B. & Maiato, H. No chromosome left behind: The importance of metaphase alignment for mitotic fidelity. J Cell Biol 218, 1086–1088 (2019).
- McIntosh, J. R., Molodtsov, M. I. & Ataullakhanov, F. I. Biophysics of mitosis. Q Rev Biophys 45, 147–207 (2012).
- Pandey, H., Popov, M., Goldstein-Levitin, A. & Gheber, L. Mechanisms by Which Kinesin-5 Motors Perform Their Multiple Intracellular Functions. Int J Mol Sci 22, 6420 (2021).
- Vukušić, K., Buđa, R. & Tolić, I. M. Force-generating mechanisms of anaphase in human cells. J Cell Sci 132, jcs231985 (2019).
- Garcia-Saez, I. & Skoufias, D. A. Eg5 targeting agents: From new anti-mitotic based inhibitor discovery to cancer therapy and resistance. Biochem Pharmacol 184, 114364 (2021).
- Yan, V. C. et al. Why Great Mitotic Inhibitors Make Poor Cancer Drugs. Trends Cancer 6, 924–941 (2020).
- Tamayo, N. A. et al. Targeting the Mitotic Kinesin KIF18A in Chromosomally Unstable Cancers: Hit Optimization Toward an In Vivo Chemical Probe. J Med Chem 65, 4972–4990 (2022).
- Marquis, C. et al. Chromosomally unstable tumor cells specifically require KIF18A for proliferation. Nat Commun 12, 1213 (2021).
- Perdomo, D. et al. TbKINX1B: a novel BILBO1 partner and an essential protein in bloodstream form Trypanosoma brucei. Parasite 29, 14 (2022).
- Fukai, R. et al. Design, synthesis, and evaluation of a novel prodrug, a S-trityl- l -cysteine derivative targeting kinesin spindle protein. Eur J Med Chem 215, 113288 (2021)
関連情報
高純度チューブリン試薬
モータータンパク質解析 Cytoskeleton Motor Werks™
Cytoskeleton(サイトスケルトン)社 CYTOSKELETON NEWS
※コスモ・バイオのホームページ上にあるCYTOSKELETON NEWSの特集ページです。
掲載元:Cytoskeleton News 2023年1月号


