はじめに
フローサイトメトリーは、多くのアプリケーションがある科学研究分野に不可欠な技術ですが、操作の基本原理はとてもシンプルです。細胞(あるいは他の粒子)を1列に並べてレーザーの前を通過させることで検出、計数、および選別を行います。このために、検出する粒子や細胞は、検出するフローサイトメトリーのレーザー波長に合った蛍光色素で標識されている必要があります。検出器のレーザーは、特定波長の光を放射する蛍光タグを励起します。フローサイトメトリーは、個々の細胞や粒子の物理的および科学的特性を迅速かつ同時にそして、複数のパラメーター分析ができる技術です。
Cosmo Bio would like to acknowledge and thank the Boster Immunoleader for providing flow cytometry technical information presented here.
フローサイトメトリーの基礎
フローサイトメトリーとは
フローサイトメトリーは、一般に広く活用されている細胞生物学技術であり、不均一な混合液中の細胞を計数、選別、および特性解析するためのレーザーを利用した技術です。フローサイトメーター装置を用いて、流動する液体に懸濁した細胞やその他の粒子が一列になってレーザー光放射位置を通過し、光との相互作用が光散乱と蛍光強度として電気検出装置により測定されます。もし蛍光標識または蛍光色素が特異的かつ化学量論的に細胞構成物と結合していれば、蛍光強度は特定細胞構成物の量を表すことができます。フローサイトメトリーは、1秒間に最大数千粒子に対して物理的かつ科学的特性を同時に多数パラメーター分析できる強力なツールです。このため、懸濁液中の細胞の分析や精製を迅速かつ定量的に行える手法として広く利用されています。フローサイトメトリーでは、細胞の表現型や機能を決定できるだけでなく、生細胞の選別も可能です。
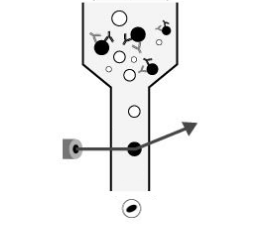
“FACS”は、fluorescence-activated cell sortingの略称であり、さらに機能性を加えたフローサイトメトリーの技術です。蛍光標識した特異性の高い抗体を用いることで、FACS解析ではほぼ無限なパラメーターに対してデータ取得と生物学的サンプルの選別を同時に行うことができます。従来型のフローサイトメトリーと同様に、 前方散布、側面散布、および蛍光シグナルデータを得ることができます。使用者は、細胞をどのように選別するかパラメーターを設定し、これに基づいて装置が各細胞に電荷をかけ、細胞を電磁石によって選別し、フローチャンバー上に位置する別の容器に振り分けられます。不均一な細胞混合物を異なる集団へと物理的に選別する本技術は、基礎研究から臨床までさまざまな分野において有用です。今日では、“フローサイトメトリー”および“FACS”という用語は、このレーザーによる生物物理学的技術を指し示す上で互換性をもって用いられることも多くあります。以下の概略図にFACS実験のセットアップと般的手順を示しました。混合細胞集団はフローサイトメーターにより陰性サンプルと対象とする陽性サンプルに選別されます。
測定可能なパラメーターの例としては、シンプルな表面免疫表現型から代謝機能、細胞周期状態、酸化還元状態、およびDNA含量まで莫大です。その発端より、FACSは生物医学的研究や臨床診断・治療において広範に使用されています。FACSの最も一般的な用途としては、以下があげられます。
●疾患診断用のヒト全血解析
●ex-vivo処置や移植のための異なる血液細胞分画の選別
●遺伝子導入/ノックアウト動物の同定のためのマウス血液の免疫表現型解析
●種々の生物学的アッセイに向けた多くの細胞株の選別と解析
●成人幹細胞や腫瘍創始細胞といった希少細胞種の特性解析と単離
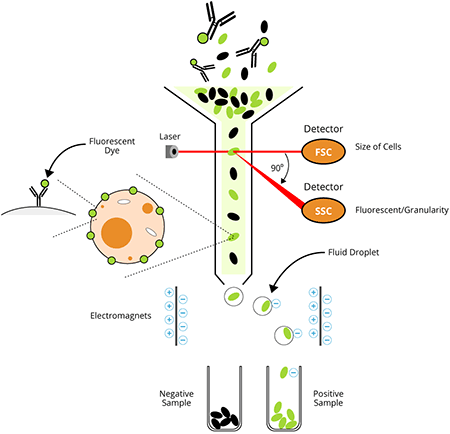
フローサイトメーターとは
フローサイトメーター装置は、流体工学、光学、および電子工学の3つの中心システムから構成されています。流体システムには、サンプル液体を注入するフローセルがあります。フローセルは、細胞や粒子が細いチャネルを通り抜け一列でレーザーが遮る部分(光放射)へ入れるように、これらを運び整列させる外筒液体を必要とします。この水力学的な焦点と、レーザー照合により1細胞ごとの解析が可能となります。光学システムには様々なフィルター、光検出器、および光源があります。光源は、通常、特定周波数で単一波長を産生するレーザー線です。この部分で粒子は最低1種類のレーザー放射を通過します。レーザーは紫外線から近赤外までさまざまな波長があり、出力レベル範囲も可変(光子出力/時間)です。レーザー放射により、抗体に結合した蛍光プローブのうち適合性をもつものは全て励起され、特定波長においてプローブから発光(または蛍光)します。励起と発光の詳細は、以下の“蛍光とフルオロフォア(蛍光染色)の選択”の項をご参照ください。
光放射の前にある検出器は前方散乱光シグナル(FSC)を計測し、横の検出器は側方散乱光シグナル(SSC)を計測します。蛍光検出器は陽性染色細胞または粒子から発せられる蛍光シグナル強度を計測します。フローサイトメーター内にはこれらの様々な光シグナルが予め決定された波長へと分割され、各感知器が特定波長においてのみ蛍光を検出できるよう、一組のフィルターとミラーにより溝が作られています。これらの感知器は光電子倍増管(PMTs)と呼ばれています。正しい波長の光子を各PMTに向けるために様々なフィルターが使用されています。ショートパス(SP)フィルターは特定波長より短い光子を通過でき、ロングパス(LP)フィルターは特定波長より長いものを通過します。バンドパス (BP)フィルターは狭い波長領域の光子のみが通過できます。各PMTは、検出対象のフルオロフォアと類似波長で発光する他のフルオロフォアも検出します。これらの光シグナルは電子システムによりデータへと変換され、ソフトウェアにより可視化され解釈することができるようになります。以下の概略図は典型的なフローサイトメーター装置の部品と仕組みを示しています。
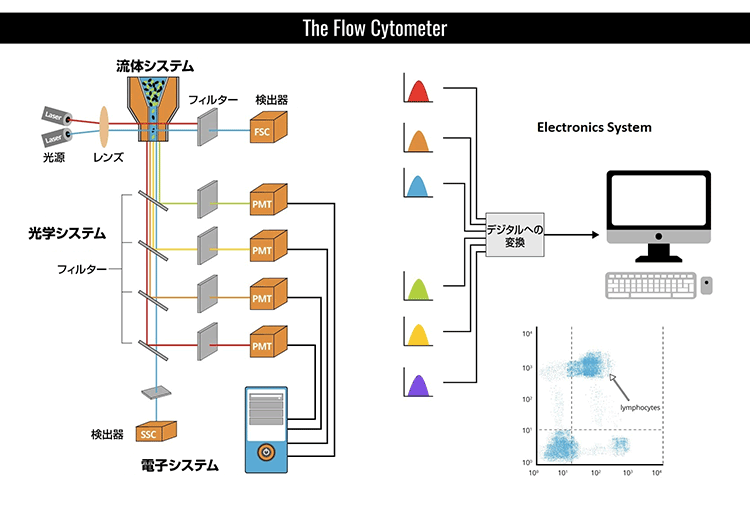
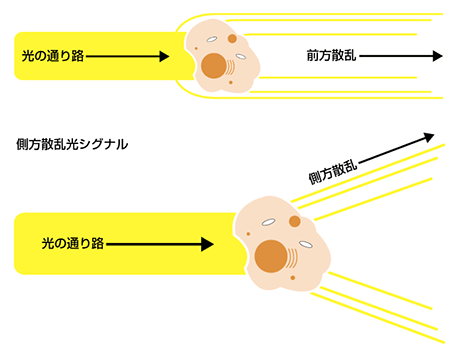
このような装置によって測定される主なパラメーターに、前方散乱光シグナル(FSC)、側方散乱光シグナル(SSC)、および蛍光発光シグナルなどがあります。前方散乱光シグナル(FSC)は、前方にある細胞により屈折された光であり、光が既に伝播している同一方向に続きます(通常、レーザー放射軸より最大20°のオフセットがある)。本シグナルは前方散乱チャネル(FSC)とよばれるPMT により回収され、一般に粒子の大きさ決定に使用されます。通常、より大きな粒子は小さな粒子に比べて前方散乱光をより多く産生し、より大きな細胞はより強い前方散乱シグナルをもっています。
FSC(前方散乱光シグナル)とは
側方散乱光(SSC)は細胞により屈折した光であり、本来の通り路から異なる方向に伝播します(励起線に対して90°の角度で測定)。通常、細胞の粒度や複雑さの情報を得ることができます。粒度や複雑性の低い細胞は側方散乱光をあまり産生せず、顆粒性の高い細胞で内部の複雑性が高いもの(好中球など)からはより高い側方散乱シグナルが得られます。細胞の形や大きさに影響されるものの、膜、細胞質、核などにより感受性です。したがって、前方と側方散乱光検出を利用することで、細胞の大きさや粒度における特性相違をもとに細胞集団を区別することができます。FSCとSSC測定値は複数の因子に影響され、サンプル調製の質に依存することから、より詳細情報を得るためにはフローサイトメトリーと蛍光標識技術を利用することもひとつの方法です。
蛍光とフルオロフォア(蛍光染色)の選択
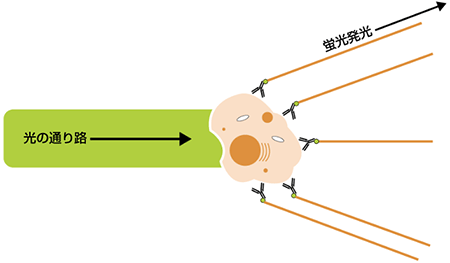
細胞集団は、FSCやSSCを基に分離することができる場合もありますが、特定タンパク質を発現するかどうかで細胞を分離することも可能です。この場合には、フルオロフォアを用いて対象のタンパク質を染色します。標的タンパク質検出に使用されるフルオロフォアは、互換性のある波長のレーザーにより励起後、発光し、これらの蛍光染色細胞または粒子を個々に検出することができます。各種の蛍光染色や標識物は独自の励起と発光スペクトラムをもち、フローサイトメトリー実験のデザインに重要な要素です。今日では、FITC, PerCP, APC, PE, Cy5.5, Alexa Fluorsなどをはじめ、多様なフルオロフォアが利用されています。蛍光標識抗体は、一般にフローサイトメトリー解析を行う上で細胞上の特定構造のラベルに使用されます。蛍光を発する細胞(または粒子)が照合点を通過し、レーザー放射と相互作用すると、時間とともに光子放出のパルスを生じます(ピーク)。これらがPMTsにより検出され、電子システムで一般に“イベント”とよばれる電位パルスとして変換されます。フローサイトメトリー機器により全パルス高と面積を測定しますが、電位パルス面積は個々の事象における蛍光強度に直接相関します。これらの現象は測定強度(パルス面積)に応じてチャネル数を割り当てられます。蛍光強度が高いほど、現象が割り当てられたチャネル数は高くなり、このシグナルはPMTを走り抜ける電位を上げることで増幅できます。
ただし、蛍光シグナルは還元型ピリジンヌクレオチド(NAD(P)H)や酸化フラビン(FAD)などの細胞内の天然で蛍光を発する基質からも生ずる、“自己蛍光”に注意が必要です。一般に、より大きくより顆粒性の細胞は蛍光化合物含量が高いことから、自己蛍光レベルが高い傾向にあります。自己蛍光レベルは未染色のコントロールを使って決定することができます。一般に、未染色コントロールやFMO(Fluorescence Minus One)コントロールは有用です。FMOコントロールは、データ解析の際に細胞を同定しゲーティングするのに役立ちます。
FMOコントロールの詳細な情報はこちらをご参照ください。
適切な蛍光物質の選択
現在ではさまざまな蛍光分子が蛍光色素、フルオロフォアとして市販されており、多彩なフローサイトメトリーのアプリケーションをデザインすることができます。これらの蛍光分子は、特定波長のレーザー光で励起し、他の波長において蛍光を発します。一次抗体にあらかじめ結合させることで、フローサイトメトリー解析用の標識済抗体を作製することができますが、この際に標識する蛍光分子の特性を理解し、ご自身の実験に適切な標識を選択することが重要です。蛍光標識の選択に必要な情報のいくつかを以下に示しました。
●最大励起波長(λex):励起(吸収)スペクトルにおける最大波長、ナノメーター(nm)で測定
●最大発光波長(λem):発光スペクトルにおける最大波長、ナノメーター(nm)で測定
●吸光計数(ε max):(モル吸光計数ともよばれる)蛍光色素が一定波長において光を吸収する能力は、通常、最大励起波長で測定され、単位M -1 cm -1で記される
●蛍光量子収量(Φf):吸収光子あたりの放射された光子数。量子収量が高いことが重要であり、この数値は0~1で示される
●蛍光減衰時間(τfl):励起した蛍光分子数がエネルギー損失により1/e(約37%)に減少するまでの時間間隔、通常、ナノセカンドで測定される
●輝度:測定されたフルオロフォア当たりの蛍光出力。高い輝度のフルオロフォアは存在量の低い標的の検出に利用できる。吸光計数(適切な励起波長)と蛍光量子収量を1000で割って単位 M -1 cm -1で示した値より算出
●ストークスシフト:最大蛍光波長と最大励起波長の差であり、ナノメーター(nm)で測定する
●レーザー線:フローサイトメトリーを用いてどのレーザー線を用いて検出するか
●共通フィルターセット:最もよい画像結果が得られる標準的な顕微鏡フィルターセット
●光安定性:基質が光への曝露で変化するためにどの程度の抵抗性をもつか
蛍光染色の特徴と選択方法の詳細はこちらをご参照ください。
(目次に戻る)
(vol.2 に続く)
掲載元:コスモ・バイオ株式会社