NaVチャネル(電位依存性ナトリウムチャネル)の様々な種類の疼痛への関与を明らかにしていくことは、慢性疼痛の治療における特異的なNaVチャネル阻害剤の開発への道を開くための突破口となるでしょう。本稿では、疼痛研究におけるAlomone Labs社のNaV関連製品を使った実験例とともに紹介します。
Right: DRG(dorsal root ganglion)とは、脊髄後根(背根)にある神経節であり、末梢からの感覚情報の中継点として機能する神経細胞の集団)は痛覚において極めて重要な役割を果たしています。
By Melanie R. Grably, Ph.D. and Lior Zornitzki, M.D.
Cosmo Bio would like to acknowledge and thank the Alomone labs for providing “NaV Channels and Pain” information presented here.
はじめに
痛覚は極めて一般的な病態生理です。電位依存性ナトリウム(NaV)チャネルのアイソフォームNaV1.7、1.8、1.9は、末梢神経系(PNS)の疼痛伝導経路に選択的に発現しています。これらのアイソフォームは、後根神経節(DRG)や三叉神経節(TG)などの末梢感覚神経節に多く局在しています。NaV1.7は、神経ペプチドサブスタンスPを含む無髄C線維と侵害受容野の遊離神経終末の両方に高度に発現しているため、特に痛覚経路に関連しています。
NaVチャネルと痛みの関連性はNaV1.7変異を持つ個体によってさらに明らかにされています。一部の変異では痛覚が完全に消失し、これらの個体は痛みを感じません。。
NaVチャネルは炎症性疼痛状態にも関与していると考えられています。複数の研究で炎症性病変を有する実験動物におけるナトリウムチャネルの変化が示されています。炎症は通常、感覚神経細胞内のNaV1.3、1.7、1.8、1.9アイソフォームの発現増加を引き起こします。
数種類の疼痛におけるNaVチャネルの役割を解明することが慢性疼痛治療のための特異的なナトリウムチャネル阻害薬の開発への道を開く可能性があります2。
NaV チャネルと痛み
再分極時に活性化されるNa+電流は、さらなる活動電位を発生させる原動力となりニューロンの反復発火に寄与します。TTX感受性(TTX-s)(tetrodotoxin: TTX)リサージェント電流は、小脳や後根神経節(DRG)ニューロンで検出され、NaV1.6依存的に発生します。最近では新規のTTX抵抗性(TTX-r)リサージェントNa+電流がラットDRGで単離されました。この電流はNaVβ4サブユニットの存在を必要とするという点で、多くの点でTTX-s復活電流と類似しています。しかしながらTTX-r リサージェント電流はより遅い動態を示し、より脱分極した電圧で発生します。また、NaV1.8特異的ブロッカーにも感受性があります。NaV1.8がリサージェント電流に関与していることが、ラットDRG溶解液中の抗NaV1.8(SCN10A)抗体(品番:ASC-016)を用いた免疫沈降研究によってさらにわかってきました。NaV1.8はNaVβ4と相互作用することも示されました。これらのTTX-r リサージェント電流は、通常の状態では侵害受容性DRGニューロンの膜興奮性に寄与している可能性がありますが、炎症性メディエーターによる両タイプのリサージェント電流の増加は、炎症性疼痛に伴う神経細胞の興奮性亢進に寄与している可能性が考えられます8。
痛みに関連した骨のがんは、部分的には、DRGニューロンの興奮性の亢進によって引き起こされます。ラットDRGのウェスタンブロット解析と電気生理学的記録より、NaV1.8チャネルの発現と活性がDRGニューロンで上方制御され、がん誘発性骨痛の発症に寄与していることが示されています3。同様のデータはNaV1.9でも観察されており、抗SCN11A(NaV1.9)抗体(品番:ASC-017)を用いたウェスタンブロット解析や免疫組織化学的検査で観察されるように、タンパク質レベルの変化が顕著です(図1)4。
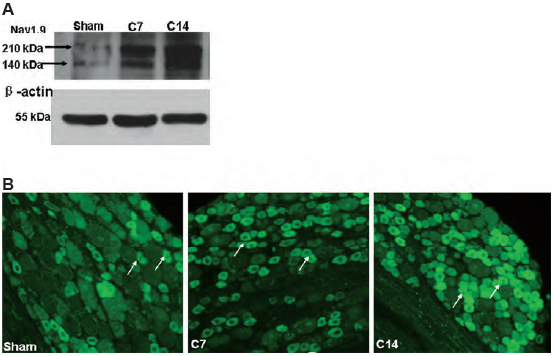
A. 抗SCN11A(NaV1.9)抗体(品番:ASC-017)を用いたラットDRG溶解液のウェスタンブロット解析。
B. A.と同じ抗体を用いたラットDRG切片の免疫組織化学染色。ウェスタンブロットと免疫染色の両方から、NaV1.9の発現が、模擬治療ラットと比較して、骨がん誘発14日後(C14)のDRGで有意に増加していることが示された。
Elsevier社の許可を得て文献4から引用。
痛みを伴う糖尿病性神経障害は、糖尿病患者にみられる痛みのある合併症です。痛みは末梢系に由来すると考えられてます。抗NaV1.8(SCN10A)抗体と抗NaV1.7(SCN9A)抗体(品番:ASC-008)を用いた免疫組織化学およびウェスタンブロット解析の両方で、小DRGおよび末梢の侵害受容性C線維においてNaV1.7およびNaV1.8チャネルがともにアップレギュレートされていることが示されました(図2)。糖尿病ラットの小DRGにおける興奮性の亢進は、糖尿病性の高発火頻度ポリモーダルC線維の伝導の低下の原因になる可能性があり、糖尿病に伴う痛覚過敏の新しいメカニズムが明らかになってきました7。
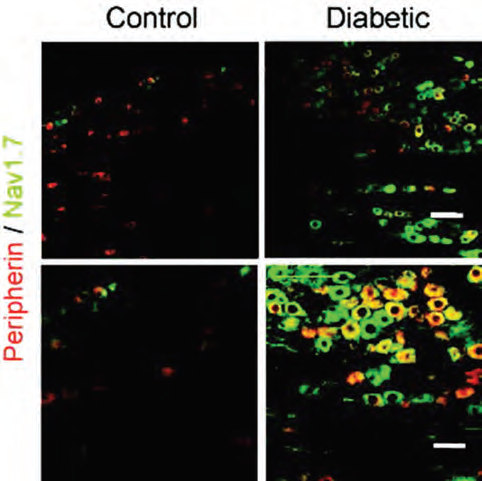
抗NaV1.7(SCN9A)抗体(品番:ASC-008)を用いたラットDRG切片の免疫組織化学染色。NaV1.7の発現(緑)はコントロールラット(左)と比較して糖尿病ラット(右)のDRGで高い。C線維マーカーのペリフェリンは赤で表示されている。上:20倍。下:40倍。
オックスフォード大学出版局の許可を得て文献7から引用。
ある研究では、侵害受容感覚ニューロンがHUES6胚性幹細胞から作製されたことが報告されています。細胞の特性は、抗TRPV1(VR1)抗体(品番:ACC-030)と抗SCN11A(NaV1.9)抗体を用いた侵害受容器の免疫細胞化学染色によって部分的に明らかにされました。これらの細胞はまた、心臓特異的なNaV1.5チャネルを発現しており、抗NaV1.5(SCN5A)(1978-2016)抗体(品番:ASC-013)を用いて染色されたことから、発生過程におけるその役割を確かなものとしました。この研究により侵害受容器がヒト多能性幹細胞(hPSC)から誘導できることが示され、さらに侵害受容ニューロンの発生過程を研究するためのプラットフォームと、標的薬理学開発の可能性が拓かれました1。
神経障害性疼痛では炎症性サイトカインが上昇します。さらに炎症性サイトカインの投与は神経障害性疼痛を誘発し、疼痛に関連したNaVチャネルの発現の増加も伴います。抗炎症性サイトカインであるIL-10は、炎症性サイトカインの影響を逆転させ、さらにNaV1.3、NaV1.6、NaV18.チャネルの発現を低下させることがAlomone Labsの抗SCN3A(NaV1. 3)抗体(品番:ASC-004)、抗NaV1.6(SCN8A)抗体(品番:ASC-009)および抗NaV1.8(SCN10A)抗体を用いた、ラット DRGサンプルにおける、免疫細胞化学およびウェスタンブロット分析で示されました。この結果はNaVチャネルのダウンレギュレーションが神経障害性疼痛におけるIL-10の効果に寄与している可能性を示唆しています5。
キネシンの一種であるKIF5は、プラス端指向性の微小管依存的なカーゴタンパク質の輸送を仲介する役割を担っています。また、軸索内のイオンチャネルを長距離輸送する上で重要な役割を果たしています。末梢の炎症や神経損傷後、NaV1.8が末梢神経に蓄積します。KIF5は後根神経節(DRG)ニューロンにおいて、NaV1.8を細胞膜と軸索に輸送する役割を担っていることが判明しました。抗NaV1.8(SCN10A)抗体を用いた免疫組織化学染色で示されるように、NaV1.8はKIF5と共免疫沈降し、両タンパク質はDRGおよび坐骨神経に免疫局在します(図3)。この研究は炎症後にNa1.8が蓄積するメカニズムを提示しています6。
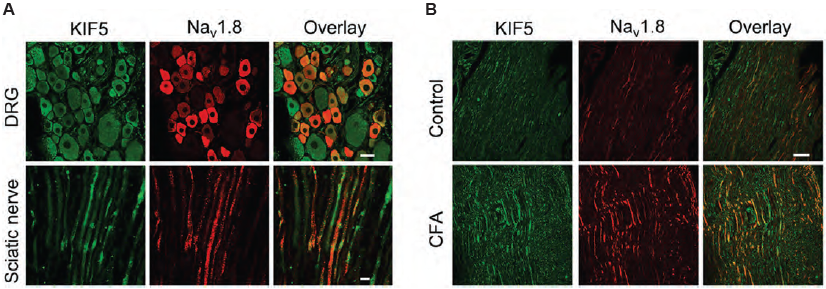
抗NaV1.8(SCN10A)抗体(#ASC-016)を用いたラットDRGおよび坐骨神経の免疫組織化学染色。A. DRGおよび坐骨神経におけるNaV1.8(赤)とKIF5B(緑)の共局在。B. NaV1.8とKIF5Bの発現は炎症誘発後に増加する。神経科学学会の許可を得て文献6より引用。
■参考文献
- Eberhardt, E. et al. (2015) Stem Cell Rep. 5, 305.
- Levinson, S.R. et al. (2012) Muscle Nerve 46, 155.
- Liu, X.D. et al. (2014) PLoS ONE 9, e114623.
- Qiu, F. et al. (2012) Neurosci. Lett. 512, 61.
- Shen, K.F. et al. (2013) Exp. Neurol. 247, 466.
- Su, Y.Y. et al. (2013) J. Neurosci. 33, 17884.
- Sun, W. et al. (2012) Brain 135, 359.
- Tan, Z.Y. et al. (2014) J. Neurosci. 34, 7190.

メーカー名:Alomone Labs
情報公開日:2024年月
掲載元:Alomone labs社 Articles ;”NaV Channels and Pain”

