Cosmo Bio would like to acknowledge and thank the iQ Biosciences for providing “The Suppressive Nature of Regulatory T Cells and Their Roles in Cancer and Diseases” information presented here.
制御性T細胞とは?
免疫応答は、リンパ球の増殖、サイトカインの分泌、外来病原体への反応、そして感染細胞の破壊といった、一連の精密に制御されたプロセスによって構成されている。免疫応答のピーク時には、細胞外の病原体は液性免疫応答によって根絶され、細胞内病原体は感染細胞を排除する細胞性免疫応答によって除去される。
しかし、いずれの場合も、活性化された免疫細胞が適切に制御されず、応答終了後も活動を続けると、組織や臓器に対する非特異的な損傷が引き起こされる可能性がある。したがって、免疫系は自己の恒常性を維持するために、活性化誘導性細胞死(AICD)の促進、TGF-βやIL-10といった調節性サイトカインの分泌、さらには免疫細胞の活性抑制を担う調節細胞(regulatory cells)を産生するなど、多層的な制御機構を発達させてきた。 同様に、自己反応性リンパ球も生体内に常在している。これらが誤って活性化され自己免疫を誘発しないようにするためには、免疫恒常性(immune homeostasis)の維持が不可欠である。その維持には、免疫耐性(tolerance)を支える調節細胞の存在が重要な役割を果たす。つまり、調節細胞は健康な生体を維持する上で、免疫系全体のバランスを保つ中心的な役割を担っている。
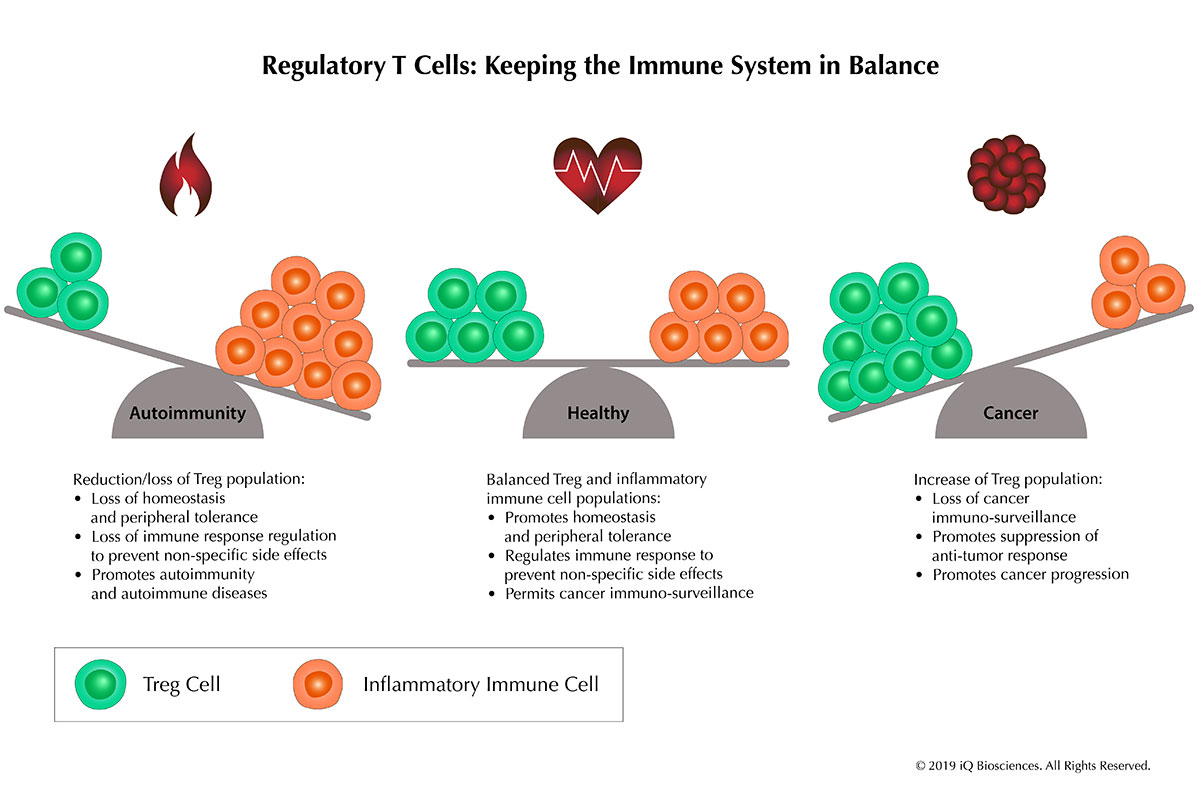
本稿では、この免疫バランスを維持するCD4制御性T細胞(CD4+ regulatory T cells, Tregs)、通称「Tregs」について解説する。特に、Tregsの存在や機能の変化が、どのようにしてがんや自己免疫疾患の発症に関与するのかを考察する。
CD4 Tregsにはどのような種類があるのか?
Treg研究の分野では、これまでに多大な努力を費やしてさまざまなサブタイプが同定されてきた。その中でも最もよく研究されているのがCD4陽性Tregs(CD4+ Tregs)である。この集団はさらに、天然Tregs(natural Tregs, nTregs)と誘導/適応Tregs(induced/adaptive Tregs, iTregs)の2種類に大別される。
nTreg(天然制御性T細胞)とは?
従来型CD4 T細胞と同様に、nTregは胸腺で発生する。発生にはIL-2依存性の刺激および共刺激シグナルが必要であり、この過程はT細胞受容体(TCR)を介したプロセスによって駆動される。また、転写因子FOXP3(Forkhead box P3)はnTregの分化・成熟に必須である。発生を終えたnTregは胸腺を離れ、末梢組織における免疫寛容(peripheral tolerance)の確立と維持に寄与する。これが自己免疫の防御機構として機能している。
iTreg(誘導制御性T細胞)とは?
一方、胸腺外の末梢組織を巡回している通常のCD4 T細胞も、局所環境からの刺激によりFOXP3の発現が誘導され、制御性T細胞へと分化する場合がある。これらが誘導制御性T細胞(iTreg)であり、腸内環境や組織内での食物抗原や共生細菌に対する免疫寛容の維持に関与していると考えられている。
しかしながら、iTregは常に生体に有益とは限らない。近年の研究では、腫瘍微小環境におけるiTregが、炎症性免疫細胞による抗腫瘍反応を抑制し、腫瘍の免疫逃避を助長することが示唆されている。
Tregの特性評価
Tregの代表的なマーカーとして、転写因子FOXP3が知られている。これはTregの発生を制御する主要因子であり、Tregの同定にも用いられる。
さらに、Tregは表面タンパク質の発現パターンによっても特徴付けられる。代表的なものとして、CD4およびCD25(IL-2受容体α鎖)が挙げられ、Tregではこれらが高発現している。加えて、CD127(IL-7受容体α鎖)はTregで低発現(CD127^low)であることが知られている。
また、TregはメモリーT細胞様の特徴を持ち、CD45RO陽性・CD45RA陰性の表現型を示す。
これらを総合すると、Tregは一般的に以下の表現型で特徴付けられる:
CD4⁺CD25⁺CD45RO⁺CD45RA⁻FOXP3⁺CD127^low その他にも、Tregは免疫チェックポイント分子(LAG-3、CTLA-4、PD-1)や共刺激分子(GITR)などを発現するが、これらは他のTリンパ球集団にも見られるため、Treg特異的マーカーとしては用いられない。
Tregによる抑制機構
初期の研究により、Tregが細胞接触依存的および可溶性因子依存的なメカニズムの双方を介して免疫抑制を行うことが明らかとなった。
細胞接触による抑制には、チェックポイントタンパク質が関与している。特にCTLA-4は、Treg上に発現する代表的な抑制分子であり、抗原提示細胞との相互作用を通じて免疫応答を抑制する。
一方、可溶性因子としては、IL-10やTGF-βが主要な役割を果たす。Tregが活性化されると、これらのサイトカインを分泌してリンパ球機能をダウンレギュレートする。また、これらのサイトカインはiTregの誘導にも必要であり、抑制と分化の両方を制御している。
さらに、Tregは「IL-2シンク(IL-2 sink)」として機能することも報告されている。高発現するCD25がIL-2を結合・消費し、局所環境中のIL-2濃度を低下させることで、他のリンパ球の活性化を抑制する仕組みである。
自己免疫疾患研究におけるTregs
ヒトでは、FOXP3遺伝子の不活性化変異により発症することが報告されているIPEX症候群(免疫調節異常・多腺性内分泌障害・腸疾患を伴うX連鎖性疾患)では、機能的なnTregが欠損しており、リンパ球の過剰活性化により重度の自己免疫反応と臓器障害が引き起こされることが示唆された。
さらに、Tregsの異常は、1型糖尿病、重症筋無力症、全身性エリテマトーデス、多発性硬化症、関節リウマチなど、多くの自己免疫疾患への関与も報告されており、Tregsは自己免疫を防ぎ、免疫恒常性と寛容を維持する鍵分子として注目されている。
がん研究におけるTregs
近年、Tregが腫瘍微小環境(tumor microenvironment)に浸潤することが多くのがん種(乳がん、肝臓がん、肺がん、卵巣がん、胃がん、膵がんなど)で報告されている。 腫瘍内にTregが存在すると、抑制的な微小環境が形成され、T細胞・B細胞・ナチュラルキラー細胞などの抗腫瘍免疫細胞の活性が抑制される。その結果、腫瘍免疫監視機構が破綻し、腫瘍の進展を許してしまう。また、抗腫瘍効果を持つCD4 T細胞が腫瘍環境によってTregへ変換される可能性も示唆されており、この現象は治療抵抗性の一因とされている。
抗がん標的としてのTregs
腫瘍におけるTregの免疫抑制作用を逆手に取り、Tregをがん免疫療法の標的とする試みが進められている。代表的なのが、抗CTLA-4抗体療法である。CTLA-4はT細胞の活性を抑えるチェックポイント分子であり、抗CTLA-4抗体はこの抑制を解除して免疫応答を活性化する。
さらに、この抗体は抗体依存性細胞障害(ADCC)を介してTregを直接標的化し、腫瘍内からTregを除去する作用も持つ。これにより、腫瘍微小環境における免疫抑制を解除し、抗腫瘍免疫を回復させることが期待されている。
まとめ
制御性T細胞(Treg)は、自己免疫疾患の抑制や免疫恒常性の維持に不可欠である一方で、がんの免疫逃避を助長する側面も持つ。つまり、その存在は両刃の剣である。Tregsの生物学的特性をより深く理解することは、新たな免疫療法の開発につながることが期待されている。
■参考文献
- Smigiel, K. S., Srivastava, S., Stolley, J. M., Campbell, D. J. Regulatory T-cell homeostasis: steady-state maintenance and modulation during inflammation. Immunological Reviews, 259(1), 2014. doi:10.1111/imr.12170. (PMCID: PMC4083836)
- Yisong Y Wan ,Regulatory T cells: immune suppression and beyond,Cell Mol Immunol. 2010 Apr 12;7(3):204–210. doi: 10.1038/cmi.2010.20
- Creg J Workman 1, Andrea L Szymczak-Workman, Lauren W Collison, Meenu R Pillai, Dario A A Vignali, The development and function of regulatory T cells, Cell Mol Life Sci. 2009 Apr 24;66(16):2603–2622. doi: 10.1007/s00018-009-0026-2
- Jason D Fontenot, Marc A Gavin, Alexander Y Rudensky, Foxp3 programs the development and function of CD4+CD25+ regulatory T cells, Nat Immunol. 2003 Apr;4(4):330-6. doi: 10.1038/ni904. Epub 2003 Mar 3.
- Azza Abdel-Gadir, Amir H Massoud, Talal A Chatila, Antigen-specific Treg cells in immunological tolerance: implications for allergic diseases, F1000Res. 2018 Jan 10:7:38. doi: 10.12688/f1000research.12650.1. eCollection 2018.
- Theresa L Whiteside , Induced regulatory T cells in inhibitory microenvironments created by cancer, Expert Opin Biol Ther. 2014 Jun 17;14(10):1411–1425. doi: 10.1517/14712598.2014.927432
- Saskia J A M Santegoets ,et.al, Monitoring regulatory T cells in clinical samples: consensus on an essential marker set and gating strategy for regulatory T cell analysis by flow cytometry, Cancer Immunol Immunother. 2015 Jun 28;64(10):1271–1286. doi: 10.1007/s00262-015-1729-x
- Dorothy K Sojka, Yu-Hui Huang, Deborah J Fowell, Mechanisms of regulatory T-cell suppression – a diverse arsenal for a moving target, Immunology. 2008 May;124(1):13–22. doi: 10.1111/j.1365-2567.2008.02813.x
- Dionne Y Honing, Rosalie M Luiten, Tiago R Matos, Regulatory T Cell Dysfunction in Autoimmune Diseases, Int J Mol Sci. 2024 Jun 29;25(13):7171. doi: 10.3390/ijms25137171.
- Yoshihiro Ohue, Hiroyoshi Nishikawa, Regulatory T (Treg) cells in cancer: Can Treg cells be a new therapeutic target?, Cancer Sci. 2019 Jun 18;110(7):2080–2089. doi: 10.1111/cas.14069
- Guoping Deng, Tumor-infiltrating regulatory T cells: origins and features, Am J Clin Exp Immunol. 2018 Oct 5;7(5):81–87.
- Tyler R Simpson,et.al., Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti–CTLA-4 therapy against melanoma, J Exp Med. 2013 Aug 26;210(9):1695–1710. doi: 10.1084/jem.20130579
関連情報
iQ Biosciences社では研究者向けに、実験で使用可能なヒトnTregsおよびiTregsを提供しています。これらの細胞は、Tregを標的とする治療薬の共培養抑制アッセイや、ADCCアッセイにご利用いただけます。 さらに、iQ Biosciencesは、共培養抑制アッセイに必要なすべての構成要素を含む「Human Treg Suppression Assayキット」も提供しております。このキットに含まれるTregは、抑制活性が検証済みであるため、安心してご利用いただけます。
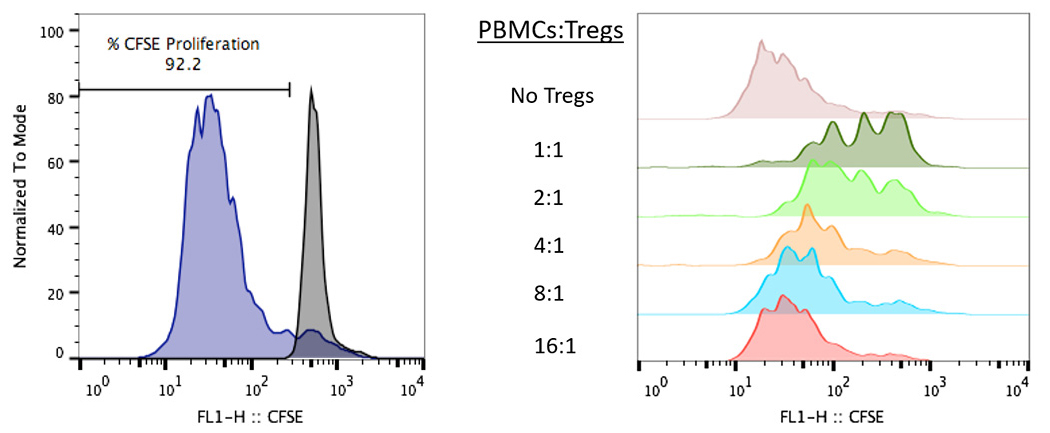
PBMCをCFSEで標識し、刺激の有無および異なる比率のTregと共培養した。4日間の培養後、CD8抗体で染色しフローサイトメトリーで解析した。
(左)非刺激(灰色)および刺激(紫色)のCD8 T細胞におけるCFSE染色ヒストグラム。
(右)異なる比率のTreg共培養における増殖抑制の程度を示す。
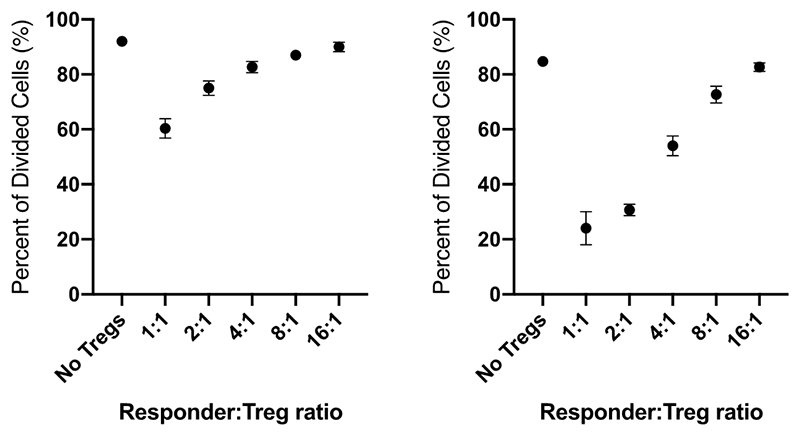
2人のドナー由来PBMCを同様の手法で解析し、CFSE希釈に基づくCD8陽性細胞の分裂率を評価した。レスポンダー:Treg比が低いほど、強い抑制効果が観察された。

メーカー名:iQ Biosciences
掲載元:iQ Biosciences社ブログ|
The Suppressive Nature of Regulatory T Cells and Their Roles in Cancer and Diseases

