Enzo Life Sciences(ENZ)社 ”10 Tips for Successful Immunohistochemistry”
1.組織標本
実験をデザインする際、組織標本が鍵となることを忘れてはいけません。組織を凍結するか、ホルマリンで固定して、パラフィン包埋するかの2択があります。どちらの方法にも欠点があります。組織を凍結すると形態の完全性が失われますし、組織を包埋すると細胞の収縮と最終的にはその組織領域に高い抗原密度を引き起こしてしまいます。どちらの方法を行うとしても、凍結組織の場合はクリオスタットで、ホルマリン固定パラフィン包埋組織の場合はミクロトームで組織を均一な切片にしてください。
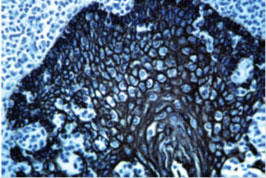
2.組織の固定
固定液は、染色の質にネガティブにもポジティブにも影響を与えます。固定剤の種類とその濃度、pH、固定時間、ピクリン酸などの添加物の有無は、組織を固定するときに考慮するすべての基準となります。固定剤の選択は組織の年齢(例えば新生児など)、組織の種類(例えば脳など)、目的抗原の性質(例えば可溶性タンパク質など)、に大きく依存します。他の研究者がどのように目的の組織を準備したかを知るために、文献検索することを強くお薦めします。
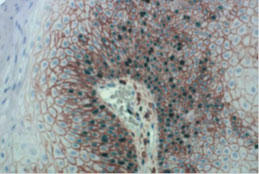
3.熱誘導もしくは酵素誘導による抗原賦活化の実施
固定の結果として、抗原がマスクされてしまい、抗体が抗原に結合できなくなってしまうことがあります。酸性バッファー中で加熱/沸騰したり、プロテアーゼで組織を酵素消化することで抗原の賦活化を助けることができます。しかし、酵素消化は組織の形態変化や抗原自身の完全性も変化させてしまう危険性があるので、抗体メーカーによる記載がない限りは、タンパク分解誘導による抗原の露出(アンマスク)よりは、熱誘導による抗原エピトープの賦活化を行うことをお薦めします。良いIHC染色を得ることができないのは、抗原賦活化が不適切、もしくは不十分だった可能性があります。クエン酸‐、EDTA-、Trisベースのアルカリ性の抗原賦活化バッファーのどれかで実験を繰り返してみることをお薦めします。さらに、抗原賦活化の温度と時間も最適化しましょう。繰り返しになりますが、文献が目的抗原に関して必要としている答えを与えてくれることがあります。熱誘導抗原賦活化を行わなかったコントロールサンプルは、抗原賦活化によって引き起こされるアーチファクトを排除するために行う必要があることを忘れないでください。
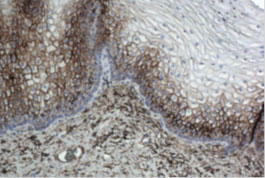
4.内因性のペルオキシダーゼ、ホスファターゼ、ビオチンの遮断
組織には、IHC染色に干渉するだけでなく、その解釈に劇的に影響する望ましくないものが発現している可能性があるという事実を忘れないでください。アビジン-ビオチンもしくはストレプトアビジン-ビオチン検出システムを使用する場合、内因性のビオチンの存在によって偽陽性が引き起こされることがあります。そのため、アビジン-ビオチンブロッキングシステムの使用を検討すべきです。アルカリホスファターゼとペルオキシダーゼはほとんどの組織で天然に発現しており、アルカリホスファターゼやペルオキシダーゼ標識の2次抗体を使用する際にアーチファクトを生むことがあります。したがって、IHC tissue primer (品番:ADI-950-234-0100) を用いた内因性酵素の遮断は、染色の特異性を保証するために重要です。
5.非特異的結合部位の遮断
抗体と組織の非特異的結合は主にFc受容体の存在によって起こります。そのため、IHC染色において非特異的結合部位のブロッキングは重要なステップです。一般的に1次抗体のインキュベーションの前に2次抗体を産生した動物種の正常血清を使用して行われます。そのような血清を利用できない場合や異なる動物種の2次抗体で多重染色する際に、universal IHC background blocker (品番:ADI-950-231-0025)は有効で多目的な代替案となるでしょう。ブロッキング時間の延長もバックグラウンド低減の助けとなるでしょう。
6.抗体の理解
組織と組織切片の入手が困難で、それらが貴重な材料である場合があります。そのため、抗体の特徴を知り理解することはとても重要です。ウェスタンブロットで抗体の性能と特異性をテストすることで、免疫組織化学における抗体の適合性に関する最初の手がかりを得ることができます。例えば、ポジティブ、ネガティブコントロールの細胞ライセートを使用することができます。上記で述べましたように、抗原賦活化プロセスの効率は様々で、IHCプロトコールを新たに確立する際には、ポリクローナル抗体の使用を強くお薦めします。その主な理由は、モノクローナル抗体は結合部位が一か所しかないのに対し、ポリクローナル抗体は複数の結合部位にアクセスできるからです。フローサイトメトリーやウェスタンブロットと同様に、抗体がワークする濃度を決定するためには滴定を行う必要があります。一般的には、パラフィン包埋したポジティブ、ネガティブ細胞を使用して行います。最適な希釈倍率の決定は、1次抗体と2次抗体の両方で行わなければならないことに注意してください。
7.正しい検出システムの選択
検出システムの選択は結果の質に非常に大きな影響を与えます。この選択は目的のターゲットの発現レベルに依存します。発現が高い抗原の観察には、標識1次抗体がの使用が望ましいです。低~中程度の発現量のタンパク質の場合、シグナル増強のために標識2次抗体を使用することを強くお薦めします。アビジン-ビオチンもしくはストレプトアビジン-ビオチンはIHC分野で最も一般的な検出システムです。内因性ビオチンをブロックする最善の努力にもかかわらず、この検出システムでは非特異的染色が起こります。現在はもっと特異的で強い染色代替法があります。これはenzyme-conjugated polymer reagentsによるもので、1次抗体の使用量を減らすことも可能となります。
8.クロモゲンの選択
明かなことかもしれませんが、色素の選択は好きな色を選ぶということではありません。染色の精度、染色の強度、対比染色(Counterstain)や封入剤との互換性は、すべて考慮する対象となります。HRPをベースとした検出システム用のDAB基質を例に挙げると、DABは反応速度、正確な沈着、一般的に使用されている対比染色及び有機溶剤系の永久封入剤と互換性があるということです。Enzo社では、最も幅広く汎用的な高解像クロモゲンのパレットを提案し、IHC実験のデザインに究極の柔軟性を提供しています。Enzo社では、独自の黄色、黒、青のHRPクロモゲンをご用意しています。ビオチンフリーナノポリマーをベースとした検出システムと組み合わせると、単一切片において複数抗原を効率的に検出するIHC多重染色プロトコールと、異なるマーカー間の発現相関を簡単に想定することができます。また試薬と人件費を削減しながら組織を保存することができます。
9.対比染色(Counterstain)と封入
対比染色はIHCプロセスにおいて鍵となるステップで、見過ごされてはなりません。対比染色は核を強調することによって、バックグラウンドとのコントラストと遠近感を提供します。ファストレッド、ヘマトキシリン、メチルグリーン、トルイジンブルーは一般的に使用されている対比染色です。異なるマーカーを異なるクロモゲンでIHC多重染色する際、対比染色はバックがラウンドとの対比を強調するために必要である、ということを忘れないでください。また、上記のようにいくつかのクロモゲン及び対比染色は有機溶剤や有機溶剤系の封入剤と互換性がないので注意してください。有機溶剤系封入剤と同様の高い屈折率をもつHIGHDEF® IHC mountのような水溶性の封入剤は、標本だけでなく、恒久的にIHC染色も保護すると考えられています。
10.コントロールの使用
他の実験同様にコントロールは重要です。あなたのIHCデータを自信をもって発表するために行うべきです。ポジティブコントールはプロトコールがきちんと機能していることを示します。通常、その抗原もしくは目的マーカーの発現が知られている組織で行われます。GeneCards、Human Protein Atlas、Uniprotなどのオンラインデータベースが適切なポジティブコントロールを見つける手助けをしてくれるでしょう。ネガティブコントロールはIHC染色の特異性を保証してくれます。ノックアウト、ノックダウン組織が推奨されます。ネガティブコントロールはアイソタイプコントロールや1次抗体なしの実験と一緒に行われるべきです。 Enzo社の高感度低バックグラウインド試薬は、市場で最も豊富な独自のクロモゲンやIHC保証されている多数の抗体と組み合わせることでプロトコールに柔軟性を与えています。Enzo社は抗原賦活化から封入までIHCプロセスの質と効率の改善に役立つ完全なセットをご提供しています。
関連商品情報
掲載元:コスモ・バイオ株式会社 技術情報