CYTOSKELETON NEWS – March 2023 | Regulation Of Actin Cytoskeleton In Intestinal Epithelial Barrier Integrity And Inflammatory Bowel Disease
炎症性腸疾患
炎症性腸疾患 (IBD) は重度の炎症を特徴とする一群の胃腸疾患であり、潰瘍性大腸炎 (UC) やクローン病が含まれます。IBD は、共生微生物に対する炎症反応、粘膜免疫反応の調節不全、上皮バリアの完全性の喪失など、いくつかの要因の組み合わせによって生じると考えられています [1、2]。腸管上皮バリアは上皮細胞の単層であり、タイトジャンクションや接着結合などの接着構造を介して互いに機械的に結合しています。これらの接着性の頂端構造は、アクチンフィラメントのような細胞骨格構造に結合する接着性タンパク質と足場タンパク質で構成されています[2]。
上皮バリアの完全性は、主要な栄養素を適切に吸収し、消化管内の外部病原体から保護するために重要です。逆に、腸上皮層が破壊されると、漏れやすいバリアが形成され、IBDの病徴が現れる可能性があります。細菌因子が頂端接合複合体、免疫細胞の活性化、細胞骨格構造にどのように影響するかなど、IBDに寄与する要因についてさまざまな研究がなされてきました。本稿では、IBD におけるアクチン細胞骨格を制御する最近同定されたメカニズムに焦点をあてます。
アクチン細胞骨格が上皮バリアの完全性を制御する
頂端結合複合体 (AJC) 内の重要なタンパク質は、IBD の発症において脱制御されています [1]。さらに、ヒト試料および動物モデルから得られたIBDの最近の質量分析プロテオミクス研究により、炎症を起こした腸で発現したアクチンの測定可能な変化が同定されました。 [3、4]。これらの研究は、アクチンが AJC および全体的なバリア機能に役割を果たしているという包括的な仮説と一致しています。さらに、細胞骨格破壊毒素、炎症性シグナル伝達分子、または細菌性病原体によるアクチンの破壊が、アクチンフィラメントの破壊と同時に起こる頂端結合の喪失につながるという初期の発見を裏付けています[2]。Ivanov グループによる最近の研究では、IBDにおけるb-アクチンの役割をin vivoモデルで明らかにしようとしたことから、腸上皮細胞から β-アクチンを特異的にノックアウトしたマウス モデルを利用して、上皮バリアにおけるアクチンの役割をさらに定義しました[5]。彼らは、これらのマウスには明らかな消化管の異常がないことを発見しましたが、これはγ-アクチンによる潜在的に補われたものと考えられました。しかし、これらのマウスでは腸管透過性が亢進したことから、大腸炎の化学誘発物質であるデキストラン硫酸ナトリウムに対するより顕著な影響を示したことに注目しました。これらのデータは、β-アクチンが適切な上皮バリア機能にとって重要であるという in vivoでの証拠を提供します。
IBDにおけるアクチン結合タンパク質とその役割
AJC の初期の研究では、AJC 複合体が内部移行し、再構成された F-アクチン収縮環と共局在するカルシウム枯渇モデルが利用されました [6]。興味深いことに、コフィリン(cofilin)、Arp3、コルタクチン(cortactin)などのいくつかのアクチン結合タンパク質 (ABP) も、これらの再構成された収縮環に共局在していました。モータータンパク質であるミオシン II も、再構成された環構造に共局在していることが判明し、ブレビスタチンによるミオシン II 機能の阻害により、AJC 複合体の分解がブロックされ、AJC 制御における ABP の役割が示唆されました [6]。最近では、ARP 2/3 阻害剤である ARPIN を枯渇させると、TJ および AJ の構造が変化すると同時にアクチン含有量が増加し、最終的には上皮バリアの透過性が増加することが示されました [7]。これは、ARPIN がデキストラン硫酸ナトリウムに応答して減少することを示す in vivo マウス データによって裏付けられました。さらに、ヒト患者の IBD サンプルでは、炎症の強い領域でも ARPIN レベルが抑制されていました。同グループはさらに、特定の薬剤CK666によるARP2/3の阻害により大腸炎の進行が軽減されることを示し[7]、これはARP2/3の微調整がIBDのアクチン制御にとって非常に重要である可能性があるという考えを支持しています。ABPを対象とした別の研究では、細菌叢がアクチン依存的に上皮バリアの完全性をどのように調節するかを調べました。その研究では、上皮バリア機能を強化することが以前に示されていたマイクロバイオーム内の特定の細菌の産物である酪酸が、synaptopodinとして知られるABPを上方制御することを発見しました[8]。その結果、synaptopodinがアクチンストレス線維内と上皮細胞のタイトジャンクションに見られることが示され、Synaptopodin欠損マウスは、デキストラン硫酸ナトリウムに反応して大腸炎の表現型を悪化させることが示唆されました[8]。本研究では、細菌叢がABPを介したアクチンの調節を通して腸のバリア機能を調節する重要なメカニズムを同定しました。
上皮バリア調節におけるアクチンを調節するその他のメカニズム
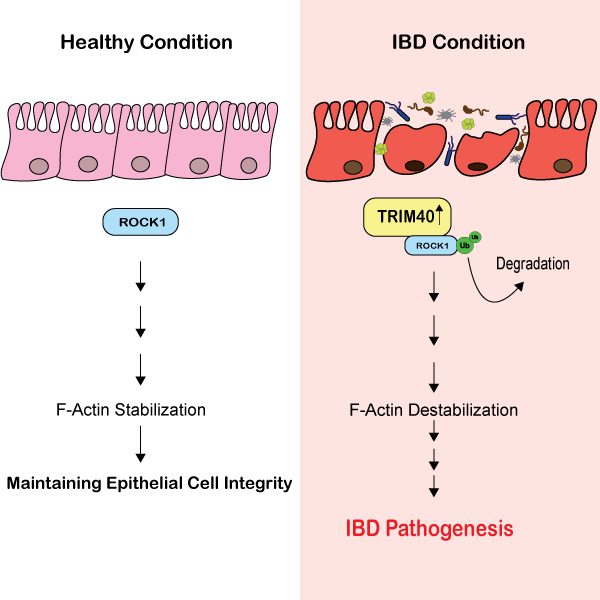
最近、IBD の一部では、ROCK1 を標的とすることが知られているユビキチン E3 リガーゼである TRIM40 (tripartite motif-containing protein 40) のレベルが増加していることが示されました [9]。TRIM40によるROCK1の枯渇は、通常はアクチン形成とROCK1/Rhoシグナル伝達を促進する重要なシグナル伝達のメカニズム(AJCの分解と上皮バリア機能の低下に関係している重要なシグナル伝達経路 [2])を抑制します[9]。この研究では、TRIM40欠損マウスは化学物質誘発性大腸炎に対して高い耐性を示し[9]、TRIM40がIBDの進行における重要な調節メカニズムであるという仮説をさらに裏付けています。Tsukitaらの研究では、液-液相分離(LLPS)が特定のタンパク質の濃度を急速に高めることを可能にするメカニズムであり、ダイナミックな細胞メカニズムにとって重要であることが示されています。最近の研究では、AJC内のタンパク質であるzonula occludens-1の濃度がLLPSによって変化し、上皮バリアの形成に重要であることが特定されました[10]。Tsukitaらによる別の研究では、微小管が新しい微小管結合タンパク質であるcordon bleuのLLPSを促進することを発見しました[11]。頂端接合部複合体のLLPSにおいて、新規のアクチン核形成因子であるコルドンブルーは、アクチンの集合を促進して上皮バリアを調節することが示されました。この研究では、上皮バリア機能の微調整に重要な、微小管とアクチンの間の新しいクロストークのメカニズムが特定されました。
今後の展望
世界全体で約6,800,000人がIBDに罹患していることが研究により示されており、現在ではIBDが大腸がん(CRC)の発生につながる主要な危険因子と理解されています[12]。Kanianら(2010)の研究では、IBDに関連したCRCの3例から、正常組織、異形成組織、がん組織が得られました。mRNA抽出後、オリゴヌクレオチドアレイを実施して、3つの組織間で発現が異なる遺伝子を同定し、アクチン細胞骨格に関与する遺伝子が3つの組織間で有意に調節不全であることを発見しました。このことから、アクチン細胞骨格経路が、異形成を介してIBD関連大腸がんへの正常な結腸粘膜の進行につながることが示唆されました[13]。AJC や細胞骨格アクチン構造の制御などを通じた上皮バリア機能の調節不全のメカニズムを理解することで、IBD の予防が可能になる可能性があります。
■参考文献
- Chelakkot, C., J. Ghim, and S.H. Ryu, Mechanisms regulating intestinal barrier integrity and its pathological implications. Exp Mol Med, 2018. 50(8): p. 1-9.
- Ivanov, A.I., C.A. Parkos, and A. Nusrat, Cytoskeletal regulation of epithelial barrier function during inflammation. Am J Pathol, 2010. 177(2): p. 512-24.
- Moriggi, M., et al., Contribution of Extracellular Matrix and Signal Mechanotransduction to Epithelial Cell Damage in Inflammatory Bowel Disease Patients: A Proteomic Study. Proteomics, 2017. 17(23-24).
- Cooney, J.M., et al., A combined omics approach to evaluate the effects of dietary curcumin on colon inflammation in the Mdr1a(-/-) mouse model of inflammatory bowel disease. J Nutr Biochem, 2016. 27: p. 181-92.
- Lechuga, S., et al., Loss of beta-Cytoplasmic Actin in the Intestinal Epithelium Increases Gut Barrier Permeability in vivo and Exaggerates the Severity of Experimental Colitis. Front Cell Dev Biol, 2020. 8: p. 588836.
- Ivanov, A.I., et al., Role for actin filament turnover and a myosin II motor in cytoskeleton-driven disassembly of the epithelial apical junctional complex. Mol Biol Cell, 2004. 15(6): p. 2639-51.
- Chanez-Paredes, S., et al., The Arp2/3 Inhibitory Protein Arpin Is Required for Intestinal Epithelial Barrier Integrity. Front Cell Dev Biol, 2021. 9: p. 625719.
- Wang, R.X., et al., Microbiota-derived butyrate dynamically regulates intestinal homeostasis through regulation of actin-associated protein synaptopodin. Proc Natl Acad Sci U S A, 2020. 117(21): p. 11648-11657.
- Kang, S., et al., TRIM40 is a pathogenic driver of inflammatory bowel disease subverting intestinal barrier integrity. Nat Commun, 2023. 14(1): p. 700.
- Beutel, O., et al., Phase Separation of Zonula Occludens Proteins Drives Formation of Tight Junctions. Cell, 2019. 179(4): p. 923-936 e11.
- Tsukita, K., et al., Phase separation of an actin nucleator by junctional microtubules regulates epithelial function. Sci Adv, 2023. 9(7): p. eadf6358.
- Stidham, R.W. and P.D.R. Higgins, Colorectal Cancer in Inflammatory Bowel Disease. Clin Colon Rectal Surg, 2018. 31(3): p. 168-178.
- Kanaan, Z., et al., The actin-cytoskeleton pathway and its potential role in inflammatory bowel disease-associated human colorectal cancer. Genet Test Mol Biomarkers, 2010. 14(3): p. 347-53.
関連商品
アクチンタンパク質・アクチン結合タンパク質
Cytoskeleton社のアクチン研究試薬
Cytoskeleton(サイトスケルトン)社 CYTOSKELETON NEWS
※コスモ・バイオのホームページ上にあるCYTOSKELETON NEWSの特集ページです。
掲載元:Cytoskeleton News 2023年3月号


