(vol.1 からの続き)
一般的な実験手順
本稿では一般的なフローサイトメトリーの実験手順をご説明します。より詳細に段階をおったプロトコールはこちらをご参照ください。
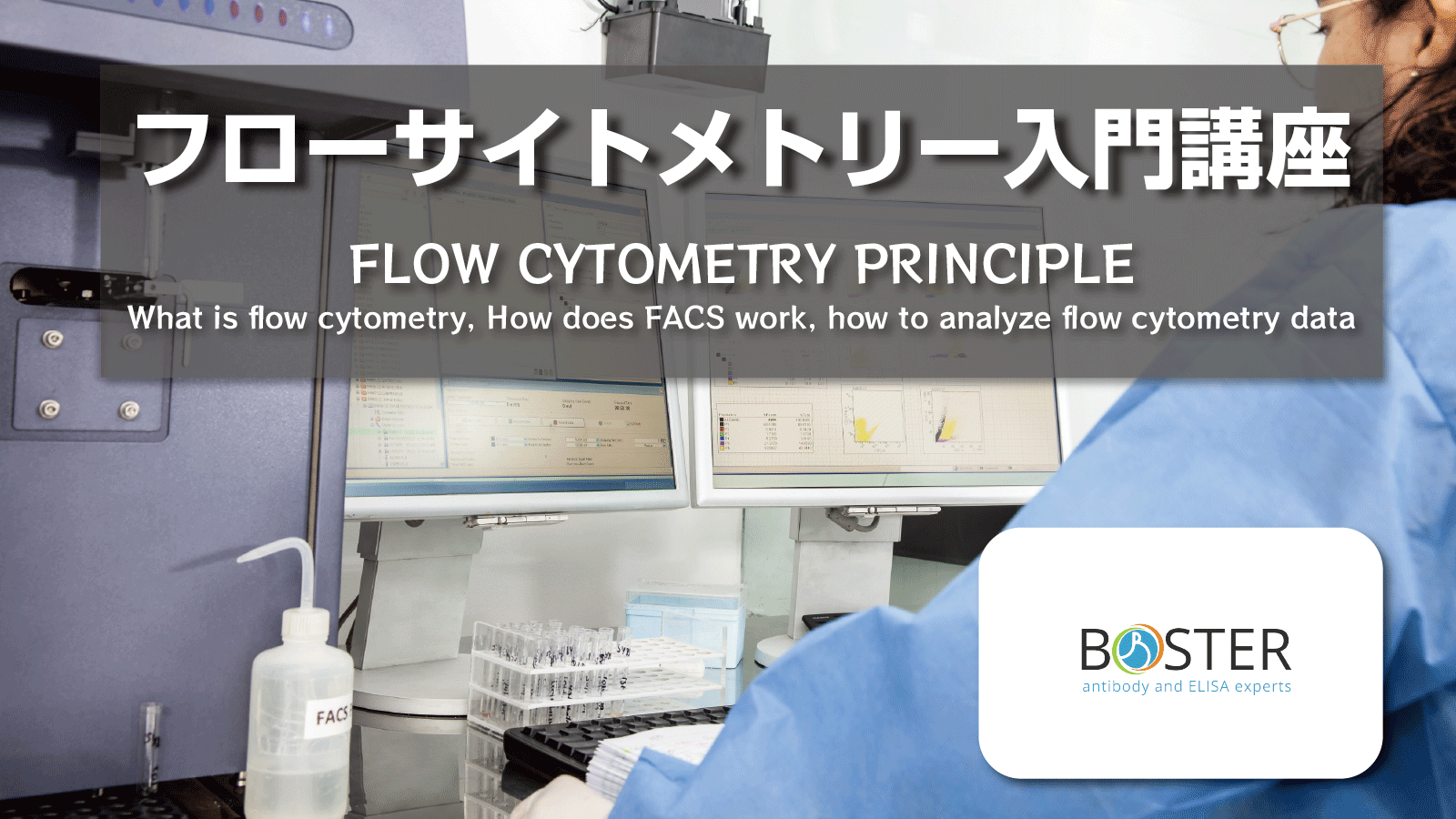
サンプル調整
どのようなフローサイトメトリー解析においても、まず、凝集塊によりシステムが詰まってしまうことをさけるために、解析する細胞が単一細胞懸濁液の状態であることが重要です。フィコール密度勾配遠心分離により全血より単離した末梢血単核細胞(PBMC)、RBC溶解全血、または非接着性培養細胞は、すぐにフローサイトメトリー解析に利用することができます。接着培養細胞または実質臓器に存在する細胞は、フローサイトメトリー解析の前に酵素による消化や組織の物理的な分離により単一細胞懸濁液にする必要があります。続いて、装置の詰まりを予防し、より質のよいフローデータを得るために物理的ななろ過を行います。その後、細胞を未標識または蛍光標識抗体とともにインキュベートし、フローサイトメトリー装置で解析します。
サンプル調整の詳細はこちらをご参照ください。
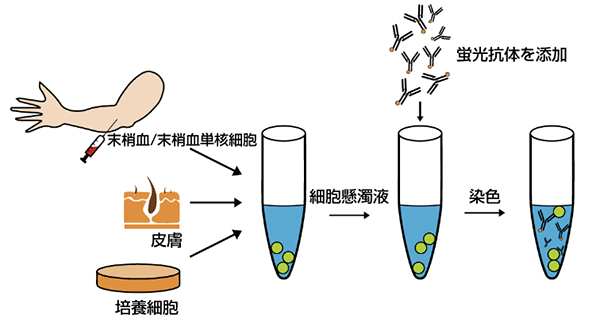
抗体染色
◆ 直接染色
細胞は、その細胞型、生物学的機能、発生段階などを特定する多くの細胞表面抗原を発現しています。由来臓器が異なる細胞は、各々特徴的な表面抗原をもち、これらの表面マーカー特異的な蛍光標識抗体を利用して細胞を直接フローサイトメトリーで解析することができます。直接免疫蛍光染色では、PerCpなどのフルオロフォアが結合した抗体と細胞を培養します。この場合、抗体のインキュベーションのステップが一度のみであり、二次抗体の非特異的結合の可能性を排除することができます。巨大な抗体-フルオロフォア複合体と二次抗体は捕捉されて非特異的結合を生ずる場合や、細胞への移行ができず検出されない可能性があるため、直接染色は細胞間内染色に有用です。もし、非標識抗体を用使用する場合には、もう1ステップ、蛍光標識済二次抗体を使用したによる染色が必要となります。
より詳細なプロトコールはこちらをご参照ください。
間接的染色
間接的染色では、蛍光標識済二次抗体が、非標識の一次抗体を検出します。あるいは、アビジンービオチンを利用した方法があり、蛍光標識済アビジンが、ビオチン標識抗体を検出します。現在多数の標識抗体が市販されており、間接的染色を行う場合には標的たんぱく質の選択肢はさらに多彩になります。フローサイトメトリー解析では、複数の標的たんぱく質に対する一次抗体を蛍光標識済二次抗体と併せて使用することもできます。
より詳細なプロトコールはこちらをご参照ください。
細胞内染色
細胞内染色手順によっては、細胞表面抗原以外の細胞質や核内に存在する抗原(サイトカインや転写因子)の直接測定も可能です。この場合には、細胞の固定化と透過処理が必要となります。
細胞を固定することで標的タンパク質が本来の細胞内位置に保持され、通常、可溶性抗原と半減期の短い抗原の安定性が上昇します。細胞内抗原を検出するには染色前に細胞を透過処理し、細胞が透過性となるよう、抗体は透過処理緩衝液中で調製します。これにより、血液や他の組織に存在する全ての細胞をそれ以上分離することなく、その機能活性を直接的に測定することが可能になります。抗体が細胞内の細胞内のタンパク質に接近するための固定法と透過処理手法はいくつかありますが、よりよい結果を得るために、in vitroで分裂促進因子による刺激を行い、細胞内でのサイトカイン産生を増やすケースもあります。このようにして使用する分裂促進因子には、PMA, Ca++、またはペプチドエピトープや、タンパク質輸送阻害剤であるブレフェルジンAなどがあります。検出前にタンパク質が細胞から放出された場合や、タンパク質分解が早い場合、分泌タンパク質などは検出が困難です。このような場合には、ゴルジ体からのタンパク質放出を妨害するブレフェルジンAや他の化合物の利用が有効です。ブレフェルジンAのようなゴルジ遮断薬はゴルジ体からの発現タンパク質分泌を阻害し、細胞内に捕捉するため、タンパク質を検出することができます。このような標的タンパク質は、細胞内染色手法などを利用して検出することができます。
より詳細なプロトコールはこちらをご参照ください。
細胞刺激・固定・透過処理
染色手順を問題なく進めるには、抗体の力価測定、固定や透過処理手順の最適化、および適切なコントロールの樹立といった実験条件の最適化が重要です。サンプルを単一懸濁液として調製し、全てのコントロールの準備ができれば、各機器説明書に準じてフローサイトメトリーを実施し、実験データを取得するだけです。
より詳細な最適化ガイドはこちらをご参照ください。
データ解析
フローサイトメトリー実験では、照合点を通過して検出された細胞は全て、個別現象として計測されます。検出された各種の光源(蛍光放出の前方散乱、側方散乱、およびそれぞれ異なる波長蛍光放出の個々に異なる蛍光波長)には特有のチャンネルがあります。各事象のデータは、各チャンネルで検出された光シグナル強度を示すため個別にプロットされます。本データは複数の方法で視覚的に表示できるため、異なる種類のデータプロットを試すと共にゲートの設定について試行する必要があります。フローサイトメトリーで広く使用されるデータとして、ヒストグラム、ドットプロット、密度プロット、および等高線図があり、また、複雑な多数のパラメーター解析ができるように、3次元プロットやSPADEツリーといったより高次数なプロット、解析技術も利用されています。
単変量ヒストグラムプロットでは、ひとつのパラメーターのみを測定します。一般に、Y軸は得られた蛍光を示す事象数(細胞数)を、X軸は単一チャンネルで検出された相対的蛍光強度が示されます。ひとつの特定強度で検出された事象数が多い場合、ヒストグラム上ではピーク(またはスパイク)として表示されます。理想的なデータは、明確なピークがひとつだけ得られ、陽性データセットとして解釈できる(細胞が期待される特徴をもつことを示す)ものです。
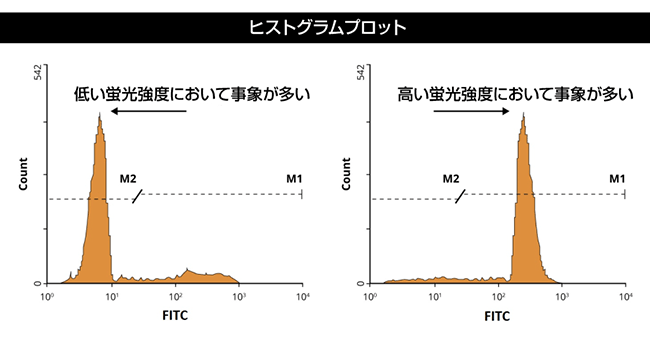
しかし、混合した細胞集団を用いてフロー解析が実施されるケースもあり、この場合にはヒストグラムでは複数のピークが生じます。このような場合には、適切なアイソタイプの陰性コントロールを用いてフロー実験を再試行することが、陽性データセットの同定に有用です。陽性結果を探す場合は、以下の模式図に示したように陰性コントロールと陽性サンプル間の変化を確認します。
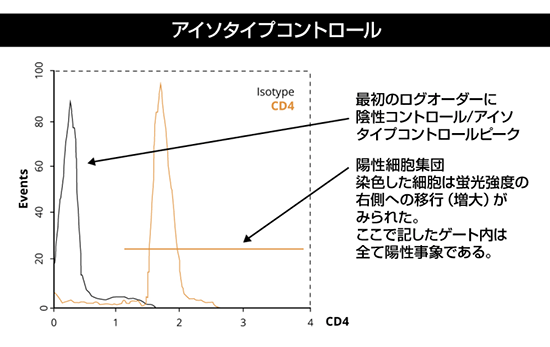
アイソタイプコントロールの詳細はこちらをご参照ください。
二変量解析では、データをドットプロットや密度プロット、等値線図で表すことが一般的です。複数のパラメーターを解析することで、2種類のマーカー間の関係を示すことができ、ゲーティングを介してより複雑な表現型の同定やターゲット集団の単離が可能となります。フローサイトメトリーのデータ解析では、ゲーティングは重要なステップで、目的の細胞を選択的に可視化し、死細胞や壊死組織片といった期待しない粒子による結果を排除するために使用します。
ゲーティングの詳細はこちらをご参照ください。
ドットプロットと密度プロットは、スキャッタープロット上で2、3種のパラメーターを同時に比較することができ、各事象は1つの点(ドット)で示されます。ドットプロットは複数の変数の関係性を一度に示す図であり、パラメーターはスキャッターや蛍光シグナルを任意で組み合わせることができます。一般的に、1) 前方散乱(FSC)vs. 側方散乱(SSC)、2) 単色 vs. 側方散乱、および3) 2色蛍光プロットの3つを組み合わせます。
密度プロットは、発現レベルだけでなく、与えられた領域における事象(密度)の相対数を示すことができます。密度プロットでは、各ドットまたは点がフローサイトメーターの照合点を通過した単一細胞を表します。異なるチャンネルにおける強度測定値を異なる軸に表すことで、スキャッタープロット上では類似した強度をもつ事象が同一領域に一緒にクラスター化されます。密度プロットはサブ集団の頻度を確認する上で有用です。
以下のドットプロットの例では、末梢血サンプル中の細胞集団が前方と側方散乱光シグナルをもとに同定できます。
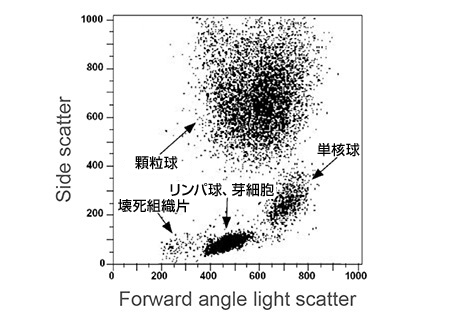
各ドットは、フローサイトメーターにより解析された個々の細胞を示す。異なる細胞集団の特徴的な状態は、細胞の大きさや粒度といった種々の物性により決定される。
壊死細胞片:
非常に小さな物品(細胞汚染物など)で低い前方散乱と側方散乱をもつ。
白血球/単核球:
内部粒度の低い小から中程度の細胞。これらの細胞は中程度の前方散乱と低い側方散乱シグナル強度を産生する。
顆粒球:
内部粒度の高い巨大細胞。これらの細胞は高い前方/側方散乱シグナル強度を産生する。
細胞によっては、その特性が前方と側方散乱プロファイルにより確認することができますが、複雑な不均一細胞集団をプロファイリングする場合、細胞種特異的マーカーの蛍光標識を利用することで、より解像度が高く確実性の高い結果を得ることができます。プロット例では、前方と側方散乱光測定値よりリンパ球と顆粒球を区別できますが、顆粒球の中には3種の分類(好酸球、好塩基球、好中球)がり、これらは細胞の大きさや構造が類似しているため、光散乱特性だけでは識別が困難です。例えば、好塩基球を同定するためには、好塩基球特異的マーカーを標的する蛍光標識抗体で選択的に標識します。
データの密度を示す方法としては、等高線図を使用する方法もあります。等高線図は、収集された事象数に関わらず、対象集団の相対的頻度を表示します。似たような細胞数を表す線をつなげて可能性のある輪郭を表示します。等高線図では集団の周囲に同心円状の輪が形成されるため、密度が高いほど輪が近くなる。そのため、本グラフでは密度が高いほど急なアイランドをもつ地理的高度図のような外観になります。5%等高線図では、5%の細胞が各輪郭線間に入ります(プロットで明らかになった通り)。したがって、最外側の線は95%の細胞が含まれ、2番目の線は90%が含まれる、といった状態になります。以下の等高線図例は、先の密度プロット例で示した細胞集団を等高線図により表示したものです。
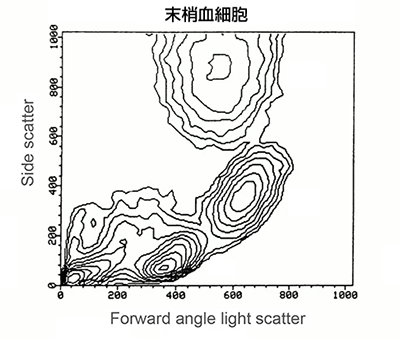
ドットプロットと同様、密度は輪郭線で表示され、異なる細胞集団の特徴的な位置が細胞の大きさや粒度なとの異なる物性により決定される。投稿線図の不利な点は、異常値を示すことが不得意であり、まれな集団の情報が目視確認できないことである。5%等高線図では、5%の細胞が最外輪郭線の外に位置する。この場合、データ解析プログラムによってはほとんどのグラフタイプにおいて異常値を付加するオプションがある。その他、密度推定とまれな事象情報を表示できる等高線図とドットプロットを組み合わせる方法がある。
(目次に戻る)
掲載元:コスモ・バイオ株式会社