(vol.5 からの続き)
実験コントロールの最適化
フロー実験は、複数のパラメーターや混合細胞集団、時には数々の実験コントロールが関与するなど、非常に複雑になる場合があります。ここでは、FACS実験に適切なコントロールを選択するためのガイドをご紹介します。
FACSコントロールの選択
フローサイトメトリー実験計画においてはじめに考慮するべきことのひとつとして、コントロールの選択が挙げられます。実験における誤差や生存率にはさまざまな原因があり、これらを制御することが非常に重要です。コントロールの目的は、フローサイトメトリー機器が適切に機能していること、正確に設定されていること、適切なゲートが描かれ、データの正しい解釈が得られることを担保することです。どのコントロールが目的のフローサイトメトリー実験に適切かを判断する指標として、以下の表をご参照ください。
| コントロール | 何を加えるか | 目的 | 注釈 |
|---|---|---|---|
| 未染色コントロール | 未染色細胞(染色サンプルと並行して培養)に抗体を添加せず、そのまま最後まで処置。 | 自家蛍光(発光)由来のバックグランドを制御し、電圧や陰性ゲートを適切に設定するため。追加の陰性コントロールとして利用。 | ビーズとの比較により相対自家蛍光(発光)の決定に役立つ。自家蛍光(発光)レベルが高い場合、異なる励起源を試行する。 |
| イソ型コントロール | イソ型コントロール抗体と共に培養した細胞(一般に、対象細胞に存在しないはずの抗原に対して産生された抗体) | 一次抗体の非特異的結合を測定するため。 | イゾ型コントロールは以下の事項と一致すべきである。
|
| 内部陰性コントロール | 対象抗原を発現しない細胞集団であり、かつ最後まで処置したもの。 | 非特異的抗体結合による偽陽性を防ぐため。 | 陰性コントロール細胞がいつも存在するとは限らない。理想的には、内部コントロールの蛍光強度は未染色コントロールのものと同等である。 |
| 陽性コントロール | 実験対象を発現することが既知の細胞。 | 質の悪い抗体による偽陰性を避けるため。 | 陽性コントロール細胞が必ず存在するとは限らない。 |
| 補正コントロール | 補正コントロールは的確な実験蛍光色素(類似した輝度をもつもの)と一致しなくてはならない。コントロールは、補正対象サンプル全てと少なくとも同等かそれ以上の明るさが必要であり、バックグラウンドの蛍光は陽性と陰性コントロールで同等であるべきである。 | スペクトルの重複を除去(補正)することが可能となる。スペクトルの重複は使用する全ての蛍光色素に対して補正する。 | 異なる蛍光色素間でのスペクトル重複のため、多色フローサイトメトリーでの単一染色は重要である。統計学的に有意となるよう十分な事象を収集する。 |
| 生存率コントロール | 死細胞を同定する一般的な生存能力色素には、DNA色素やタンパク質結合色素がある。 | 生存率染色による死細胞除外することで、非特異的結合の低減と陽性染色集団の同定が容易となる。 | 生/死染色を利用して死細胞を除去することで、染色が改善する。死細胞はより大きな自己蛍光発光をもち、非特異的抗体結合を増大させるため、偽陽性やダイナミックレンジの減少の原因となる。 |
| Fc 遮蔽コントロール | 染色手順においてFc 遮断試薬を添加。市販のFc遮断薬を利用できる。 | 抗原特異的結合のみが生ずることを保証するため(Fc受容体を介した抗体結合が偽陽性を誘導し、データの解釈が不能となる)。 | 代替法として、宿主血清の一次抗体を使用することもできる。例えば、対象抗体がマウスのイソ型であれば、マウス血清を免疫グロブリン/抗体のFc受容体への非特異的結合遮蔽に使用できる。精製PBMCには、10%ヒト血清が利用できる。 |
| 蛍光マイナス1(FMO) コントロール | 多色パネルで使用する全ての蛍光色素に対して、全蛍光色素よりそれぞれ1種類のみ減らして実験細胞を染色する。 | 検出チャネル内の蛍光分散の影響を検出するため(特により明るい蛍光色素)。 | 多色フローサイトメトリーパネルの構築に重要であり、ゲートをどこに設定するか決定する際に役立つ。 |
| 二次抗体コントロール | 二次抗体のみと培養した細胞。 | 二次抗体の非特異的結合を同定する。 | 二次抗体を使用する場合にのみ必要。 |
蛍光色素の最適化
蛍光分子は蛍光色素、フルオロフォア、蛍光色素としても知られ、多くの市販品をフローサイトメトリーに利用することができます。一次抗体にあらかじめ標識することでフローサイトメトリー解析がより簡便になります。以下のガイドをご参照ください。
多色パネルデザイン
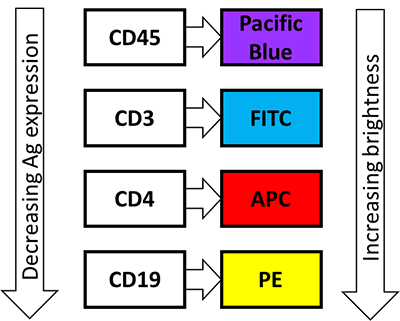
- 最も明るい蛍光色素と低発現の抗原とを組み合わせる。抗原の発現レベルが不明な場合、より明るめの蛍光色素を用いることが望ましい。
- 蛍光色素間の流出やスペクトル重複を防ぐため、蛍光色素のスペクトラムを可能な限り分散させる。
- 1つ以上のレーザーで励起する蛍光色素(APC/Cy7など)は避ける。
- もし、3と4ポイント以上が得られない場合は、適切な補正コントロールを使用する。
- 染まり方が異なるサブ集団をより正確にゲートするため、FMOコントロールを使用する方がよい。
- 市販のオンライン多色パネルデザイナーの使用を考慮する。ポイント1~3を描画する際、適切な4色パネルを使用する。下図のボックスの色は各蛍光色素を励起するレーザーに相当する。
細胞刺激最適化(細胞内サイトカイン染色用)
フロー実験を最適化するためには、細胞内サイトカインの産生を最大化するため、さらにin vitroで細胞刺激が必要な場合があります。このような目的によく使用される試薬としては、PMA, Ca++、ペプチド抗原決定基、タンパク質輸送阻害剤、ブレフェルジンAなどがあります。
下表に、標的タンパク質に対する刺激物とその培養時間を簡単に示しました。
| 標的サイトカイン/リン酸化タンパク質 | 標的細胞 | 刺激物 | 処理時間 | 表面マーカー |
|---|---|---|---|---|
| IL-2 | PBMCs | PMA (50ng/ml) | 4-6 hours | CD3 |
| IL-3 | T-cells | PMA(50ng/ml) + ionomycin (1µg(ml) | 4-6 hours | CD4 |
| IL-4 | PBMCs | PMA(50ng/ml) + ionomycin (1µg(ml) | 4-6 hours | CD4 |
| IL-6 | PBMCs | LPS (100ng/ml) | 4-6 hours | CD14 |
| IL-10 | PBMCs | LPS (100ng/ml) | 18-24 hours | CD14 |
| GM-CSF / IFNγ / TNFα / TNFβ | PBMCs | PMA(50ng/ml) + ionomycin (1µg(ml) | 4-6 hours | CD3 |
| pStat5 | PBMCs | GM-CSF (20ng/ml) + IL3 (20ng/ml) | 15 min. | CD123, CD116 |
| pStat3 | PBMCs | G-CSF (20ng/ml) + IL6 (20ng/ml) | 15 min. | CD126, CD114 |
| pERK | PBMCs | IL3 (20ng/ml) + IL6 (20ng/ml) + FLT3L (20ng/ml) | 15 min. | CD123, CD126, CD135 |
フローサイトメトリー解析における免疫染色の最適化
抗体を使用した染色手順には、抗体滴定、洗浄、ブロッキングなどの多くのステップが含まれます。最小限のバックグラウンドで最良の染色が得られる至適抗体濃度は実験的に決定する必要があります。抗体染色プロトコールの各ステップの最適化に以下のガイドをご参照ください。
- 製造元の指示に従って抗体の保存と取扱いを行い、崩壊とFc受容体介在性凝集を避ける。
- 高速遠心を4°Cで5分間行い、抗体凝集物を除去する。PE標識したIgM抗体は大きいため、本ステップは推奨しない。
- 抗体結合反応を氷上で直接光を避けて行う。
- 接着細胞を用いる場合、トリプシンが細胞表面抗原を切断する場合があるため、トリプシン処理は行わない。
- 抗体を希釈して分注保存する場合、染色緩衝液を希釈に用いる。0.09%アジ化ナトリウムを添加して細菌汚染を防ぐ。
- 各培養段階後に細胞を染色緩衝液で1回か2回洗浄し、結合していない抗体を除去する。
- 抗原が弱い場合にはシグナルを増大させるため、3ステップ染色過程を行うことも考慮する。この場合、ビオチン標識した一次抗体との抗原結合→ストレプトアビジン抱合型二次抗体との結合→蛍光色素に抱合した抗ストレプトアビジン抗体との最終結合、を行う。
- 死細胞や細胞堆積物を排除するため、抗体カクテルに生存率解析用試薬を添加する。
- 非特異的Fc受容体染色を防ぐため、Fc遮断ステップを行うか、FBSを染色緩衝液に添加する。または、イソ型コントロールを用いてFc受容体染色により得られたシグナルを差し引く。
- 蛍光色素のブリーチングを最小限に抑えるため、染色後、直ちに細胞を確認する方がよい。細胞を保存しなくてはならない場合、適切な固定液で固定し、4°Cで保存する。一晩保存する場合、0.5% PFA Iが好ましいが、複数日や複数週にわたるなどの長期では、エタノール固定を推奨する。
- 固定液に長期保存すると自己蛍光が顕著に増大するため、推奨しない。
- 最適なシグナルを得るために、抗体の正確な濃度を決定できるよう抗体滴定を推奨する。抗体の希釈率を種々試し、陽性コントロールで最も強いシグナルを与えネガティブコントロールで最も弱いシグナルを与える最低濃度において零点規正を行う。
お手元の抗体の濃度が不明な場合には、以下の推奨希釈率をご検討ください。
| 組織培養上清 | 腹水 | 全抗血清 | 精製抗体 |
|---|---|---|---|
| 1/100 | 1/1000 | 1/500 | 1 µg/mL |
掲載元:コスモ・バイオ株式会社