2024年2月17日、和歌山工業高等専門学校の生物工学学生実験室にて、公開講座『Biodiversity and Chemistry in KOSEN 生物の不思議を調べてみよう!』の後編が開催されました。今回のテーマは『PCRについて知ろう』です。
前編では、受講者自身のDNAを取り出して観察する実験を通して、DNAという物質の存在とその基本的な仕組みに触れました。後編では、PCR(Polymerase Chain Reaction:ポリメラーゼ連鎖反応。DNAの特定の部分を短時間で大量に増幅する技術)を学びます。この技術は、コロナウイルス感染拡大の中で注目されたウイルス検出の仕組みだけでなく、さまざまな分野や研究に応用されています。
今回の講座には、小学5年生から中学2年生までの15名が参加しました。受講者の皆さんは、細菌からDNAを抽出し、そのDNAを用いてPCRと電気泳動を体験しました。実験を通じてPCRの原理や利用法、さらにウイルス検出の仕組みに対する理解を深めることができました。
▶和歌山工業高等専門学校 公開講座2023 前編 – 遺伝子を取り出そう – はこちら
PCRについて知ろう – ウイルス検出とPCR –
コロナウイルス感染拡大に伴い、『PCR』という言葉は多くの人に知られるようになりましたが、その仕組みや原理について詳しく知っている人はまだ少ないのが現状です。
今回の実験では、まず大腸菌からDNAを抽出し、そのDNAを使ってPCRと電気泳動を体験します。この実験を通じて、PCRの基本的な仕組みや利用法を学び、コロナウイルスの検出がどのように行われるのかを理解します。また、実験に入る前に、全員でマイクロピペットの使い方を練習し、正確な操作を確認します。
大腸菌DNAの抽出とその濃度測定をおこなう
事前に培養した大腸菌から、コスモ・バイオ寄贈の細菌用DNA抽出キット(G-spin™ ゲノムDNA抽出キット)を使用してDNAを抽出しました。ここでは手順の概要を紹介します。
① 細胞の破壊:大腸菌液 1 mL を13,000 rpmで1分間遠心分離を行い、上澄みを除去し、試薬1を0.3 mL 加えてしっかり攪拌する。
② 加熱処理:65℃で15分間加熱処理を行う。
③ カラムへの移動:試薬2を 0.25 mL 加え、中身をカラムに移す。13,000 rpmで1分間遠心分離する。
④ 洗浄:試薬3を0.5 mL加え、13,000 rpmで1分間遠心分離する。同様に、試薬4を0.5 mL加え、再度13,000 rpmで1分間遠心分離する。
⑤ DNAの回収:カラムを新しいチューブに移し、試薬5を0.1 mL加え、13,000 rpmで1分間遠心分離する。この時、カラムから落ちた液体に大腸菌のDNAが含まれる。
⑥ DNA量の測定:専用の装置を使って抽出したDNA溶液の濃度を測定する。
PCRでDNAを増やす
ここでは、抽出した大腸菌のDNAをPCRで増幅しました。PCRには、コスモ・バイオ寄贈のPCRキット(AMPIGENE® Taq DNA polymerase)を使用しました。以下に手順の概要を紹介します。
① 反応液の準備:PCRチューブに試薬6を11.4 µL加える。DNA溶液1 µLと水を加え、最終量を50 µLに調整する。
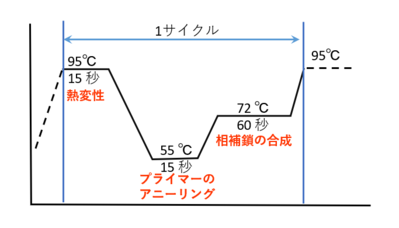
② サーマルサイクラーでPCRをおこなう。サーマルサイクラーを用いて以下の反応をおこす。
- 95℃で15秒(熱変性)
- 55℃で15秒(プライマーのアニーリング)
- 72℃で60秒(相補鎖の合成)
- 上記のサイクルを必要回数繰り返す。
電気泳動で増やしたDNAを確認する
ここでは、PCRで増やしたDNAの特定の部分が正しく増幅されているかを電気泳動法を用いて視覚的に確認します。手順の概要は以下の通りです。
① ゲルの準備:電気泳動槽にアガロースゲルをセットし、ゲル全体が浸るようにTAEバッファーを注ぎ入れる。
② サンプルの準備とアプライ:PCRで得られた各サンプル 10 μLにローディングバッファーを混合する。それをアガロースゲルのウェル(穴)に慎重に注ぎ入れる(アプライ)。
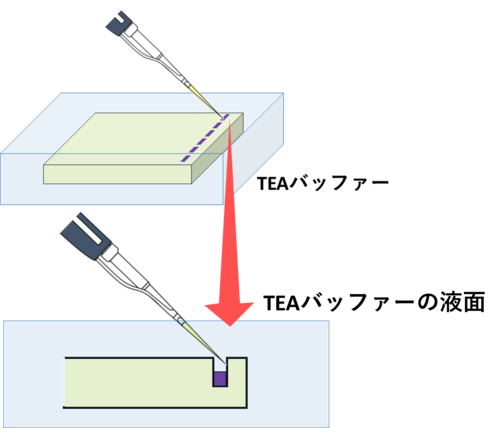
③ 電場をかける:電気泳動装置の電源を入れ、適切な電圧を設定して電場をかけ、DNAをゲル内で分離させる。
④ 染色:電気泳動が完了したら、ゲルを取り出し、蛍光染色剤を使用してDNAバンドを染色する。染色剤を扱う際には安全対策を徹底する。
⑤ バンドの確認:染色したゲルを紫外線照射し、DNAのバンドを観察する。バンドの位置やサイズが期待通りであれば、PCRが成功していることを確認できる。
受講者の皆さんの様子
はじめに、マイクロピペットの使い方の練習をしました。マイクロピペットの扱いに慣れていない受講者が多く、操作ミスを避けようと慎重に取り組む姿が印象的でした。特に微量な液体を正確に吸い上げたり、移したりする場面では、受講者たちのやや緊張した表情がみられました。
その後、大腸菌からDNAを抽出する実験に移りました。DNA抽出キットを使い、参加者はマイクロピペットを用いて 1mL 以下の微量な溶液を慎重にあつかいながら工程を進めました。抽出したDNAを測定装置で確認する際には、わずか 2μL の溶液を扱う必要があり、一段と緊張感がありました。

DNAの抽出には待ち時間が長い工程があるため、その間にPCRの原理について、ティーチングアシスタントの学生さんが解説をしてくれました。DNAとPCRに関する基本的な内容や操作説明が、身近な例を交えたわかりやすい言葉で説明され、参加者たちは熱心に耳を傾けていました。

次に、ユニバーサルプライマーを用いたPCRに挑戦しました。参加者たちは、DNA抽出よりもさらに微量な試薬を扱う工程を慎重に進めました。

電気泳動では、PCR産物をアガロースゲルに注入する際、細いウェルにサンプルを正確に入れる必要がありましたが、参加者全員が失敗することなく操作を完了させました。電気泳動が始まり、自分の手で増幅させたDNAのバンドがきれいに現れたとき、参加者の表情には安堵と達成感が浮かびました。

受講者アンケートの結果
さらに興味が湧いた、理解できて楽しかった、知って良かったといった多くの声が寄せられました。以下に、アンケート結果の一部を抜粋してご紹介します。
- 草などでPCRをして色々なものを集めてみたい。
- 喋ってくれている高専生の方々もとても分かりやすく話してくれて、少しだけDNAの事が分かった気がします。
- PCRの意味も知らなかったし、DNAは3㎝ぐらいの物かなと思っていましたが、思っていた何倍も長くて驚きました。頬っぺたを噛むとDNAが出てくるのは怖かったですが、人間も仕組みがあってこう生きているのだと人体に興味がわきました。ありがとうございました。
- 今までPCRについてなんとも思っていなかったけど、今日の講座を受けて興味がわきました。知らないことについて知ることができて、楽しかったです。
- PCRの原理や使う方法が良く分かった。
ウイルス検出とPCR – 奥野先生の講義 –

新型コロナウイルスの感染拡大以降、『PCR検査』という言葉をよく耳にするようになりました。しかし、PCRという技術がどのような仕組みで動いているのか、また、なぜPCR検査で新型コロナウイルスの陽性・陰性が判断できるのかを、詳しく知っている人はまだ多くないかもしれません。今日はこのPCR検査の仕組みをお話しましょう。
ウイルスは、DNAやRNAといった遺伝物質を持っていますが、自力で増殖することができないため、厳密には『生物』とは言えません。PCRは、このウイルスが持つ特定の遺伝子部分を増幅することで、ウイルスの存在を特定できる非常に便利な技術です。PCRによって、ウイルス固有の遺伝子部分を増やすことで、そのウイルスが存在するかどうかを確認することができます。
新型コロナウイルスとPCR
新型コロナウイルスは『RNAウイルス』に分類されます。RNAウイルスとは、DNAではなくRNAを遺伝物質として持つウイルスのことです。RNAはDNAと似ていますが、塩基の1つが異なり、『ウラシル』という塩基を含む点が特徴です。
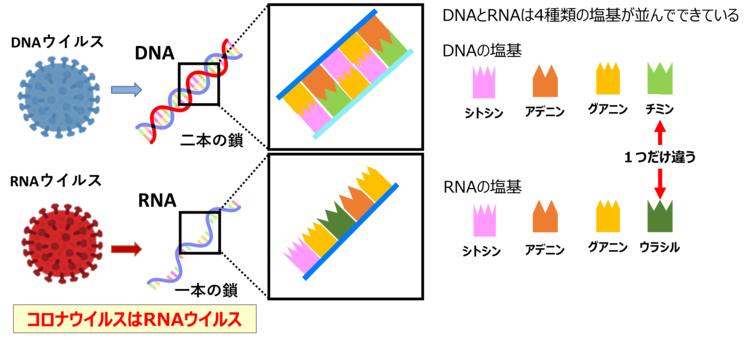
PCR検査で新型コロナウイルスを検出する際には、RNAを一度DNAに変換する工程が必要です。この手法は『RT-PCR(逆転写PCR)』と呼ばれます。RT-PCRでは、RNAから合成されたDNAをPCRによって増幅することで、ウイルスが存在するかどうかを確認します。
リアルタイムPCRによる迅速な判定
PCRの中でも、『リアルタイムPCR』という技術では、DNAの増幅量を光の強さとしてリアルタイムでモニタリングすることができます。この方法により、電気泳動が不要となり、迅速かつ定量的な結果を得ることが可能です。蛍光プローブを用いることで、ウイルス特有のDNAが増えるに従い光の強さも増し、一定以上の光の強さに達すると陽性と判断される仕組みになっています。
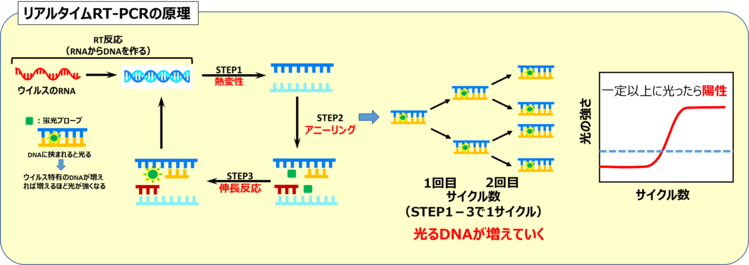
PCRは、ウイルス検出だけでなく、様々な病原体の特定や遺伝子研究など、幅広い分野で活用されています。特に新型コロナウイルス感染症の流行時には、感染拡大を防ぐために重要な役割を果たしました。このように、PCRは現代の医療や科学を支える欠かせない技術となっています。
奥野先生に聞いちゃおう!遺伝子の不思議

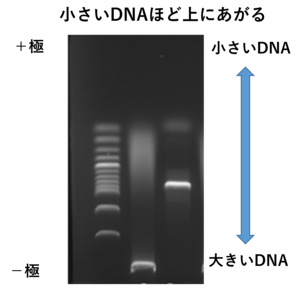
DNAの電気泳動の仕組みをわかりやすく教えてください!

DNAはリン酸基を含むため負の電荷を持ち、電場をかけると陽極(プラス極)の方向に向かって移動します。電気泳動法ではこの特性を利用してDNAを分離するんです。
アガロースゲルやポリアクリルアミドゲルは、DNAが移動する通路の役割を果たします。これらのゲルには細かい網目構造があり、DNAがこの網目を通過する際、分子サイズの違いにより移動速度が異なります。具体的には、小さい分子ほど網目をすり抜けやすく、速く遠くへ移動します。一方、大きい分子は網目に引っかかりやすく、移動速度が遅くなります。この性質を利用して、DNAを分子サイズごとに分離します。

電気泳動による分離が完了した後、ゲルに染色剤を用いることでDNAを可視化します。一般的に、エチジウムブロマイドやSYBR Greenなどの蛍光染色剤を使用し、紫外線トランスイルミネーターで照射することでDNAバンドが現れます。これにより、DNAのサイズや量を確認することができます。

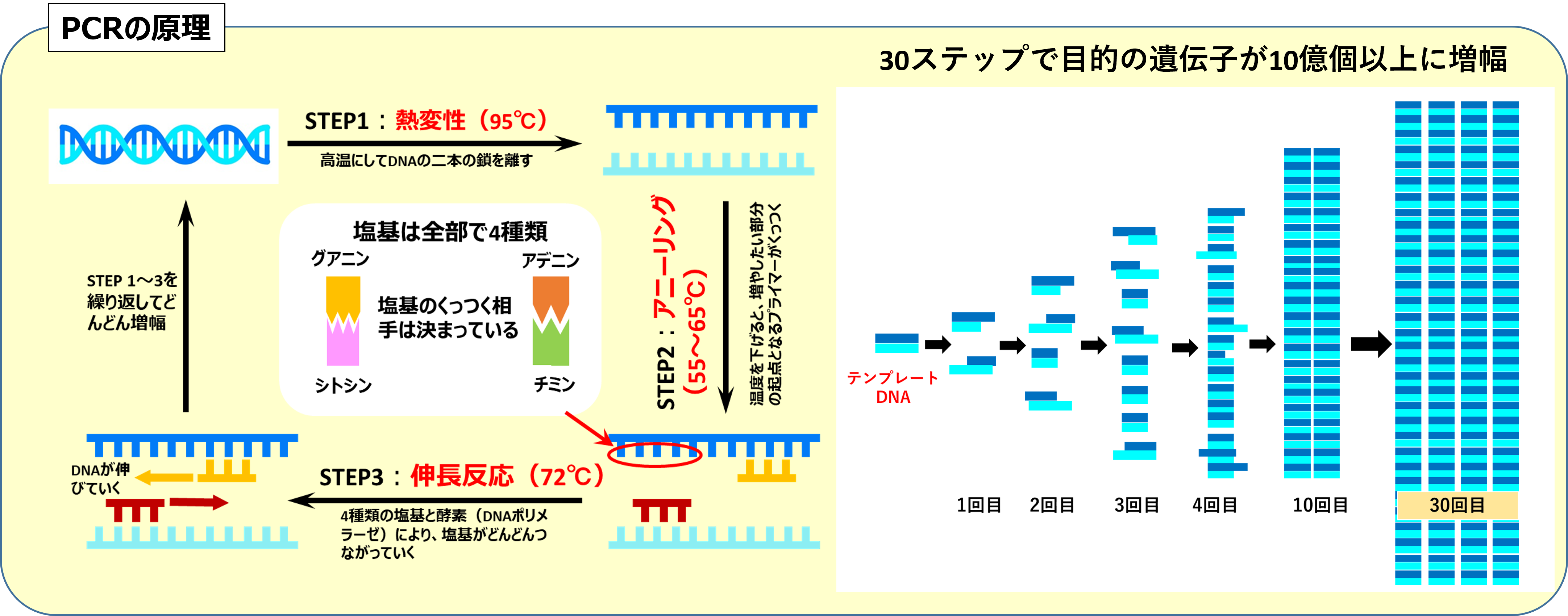
PCRをわかりやすく教えてください!

PCR(Polymerase Chain Reaction)は日本語で『ポリメラーゼ連鎖反応』といい、1980年代に開発された画期的な技術です。この技術を使うと、わずかなサンプルから特定の遺伝子を短時間で増やすことができます。30回のサイクルを行うだけで、目的の遺伝子が10億個以上に増えるほど効率的なんです。
PCRの仕組みを簡単に説明すると、まずDNAを加熱して2本鎖を1本鎖に分けます。これを変性(デネチュレーション)と呼びます。次に、DNAの特定の部分を見つけ出すために『プライマー』という短いDNA断片を使います。このプライマーがDNAにくっつく工程をアニーリングといいます。アニーリングでは温度を適切に下げて、プライマーが正確な位置に結合するようにします。その後、DNAを合成する酵素であるポリメラーゼが働いて、新しいDNAを作ります。この段階を伸長(エクステンション)といいます。この3つのステップ(変性、アニーリング、伸長)を1サイクルとして繰り返すことで、DNAを指数関数的に増やすことができます。
後記
今回の公開講座『PCRについて知ろう』では、PCRという技術を座学だけでなく、実際の実験を通じて学ぶ機会が提供されました。受講者の皆さんは、大腸菌からDNAを抽出し、それを用いてPCRと電気泳動を体験することで、理論だけでなく、実際にどうなるのかをより実感できたのではないでしょうか。
また、新型コロナウイルス感染症の流行をきっかけに注目されたPCR技術を通じて、科学の魅力やその応用の広がりを伝える場となりました。受講者の皆さんにとって、未知の技術や理論に挑戦する楽しさや、科学の奥深さを感じる貴重な時間となったことを願っています。
次回の講座でも、さらに多くの学びと、それに伴う驚きや喜びが生まれることを楽しみにしています!
【写真・イラストの引用元について】
本記事内で使用した写真・イラストは、奥野先生のご厚意により、共有していただいた資料から引用させていただいております。

