宇都宮大学 公開講座レポート
ミジンコから学ぶ 生き物の形づくり ~遺伝子で決まる形と決まらない形~
本講座は高校生のみなさんに最先端のバイオテクノロジーに触れることで、科学に対する興味や関心を高めてもらうことを目的にしています。DNA鑑定や遺伝子組み換えに関する実験を行い、DNAを「見る・知る・触る」ことによって、バイオテクノロジーの基礎から実験までを体験します。
毎年、宇都宮大学 バイオサイエンス教育研究センターの主催でおこなわれ、2023年度は2日間のプログラムが計4回開催されました。人気の講座で本年度も多くの高校生が参加しました。
本稿では、2023年8月7日、8日の2日間にわたり開催された体験講座の中で、3つめの実験であるミジンコの遺伝子鑑定についてレポートします!
▼ Vol.1はこちら
▼ Vol.2はこちら
体験講座 実施内容
実験3:からだの形が違うミジンコの遺伝子鑑定をしてみよう!
この実験の目的は?
実験3では、ミジンコとオオミジンコのメスとオスからDNAとRNA(DNAと似た遺伝物質で、生き物のタンパク質をつくる働きに深くかかわる)を取り出し、DNAはPCR(ポリメラーゼ連鎖反応。遺伝子を増幅させることが可能) で、RNAは逆転写PCRで増やし、ゲル電気泳動で分離してそれぞれに違いがあるかどうかを分析します。

生き物の形づくりにおける遺伝子の働きを更に学ぶとともに、同じ遺伝子を持っていても、生き物の形は環境の影響を受けて変化することを学びましょう!
遺伝子鑑定では、ミジンコのDNAをPCRで増幅し、可視化することで比較します。同様に、逆転写PCRでミジンコのRNAをcDNA(相補的DNA。逆転写酵素によって複製されるcDNAはmRNAと相補的な塩基配列になる)として増幅し、可視化することで比較します。
DNAを比較することで遺伝情報にどういった違いがあるか、RNAを比較することで合成されるタンパク質にどういった違いがあるかを学びます。
実験するための準備をしよう!
- ミジンコ( Daphnia pulex )のメスとオス
- オオミジンコ( Daphnia magna)のメスとオス
- DNA・RNA抽出キット(タカラバイオ社製 NucleoSpin RNA XS を使用)
- 70% エタノール
- 1.5 mlマイクロチューブ、または 15 ml 遠心チューブ
- マイクロピペット、ピペットチップ
- 卓上遠心機
- PCR反応液・逆転写PCR反応液、PCRチューブ
- サーマルサイクラー(PCRを行うための装置)
- 電気泳動用の 2% アガロースゲル
- マーカーDNA溶液
- ゲル電気泳動装置
- エチジウムブロマイド(DNAを染色する試薬)
- 紫外線灯(DNAを観察するために利用します)
からだの形が違うミジンコの遺伝子を比べよう!
準備がすんだらミジンコの遺伝子鑑定スタートです。ミジンコのDNAとRNAを取り出して増やし、ゲル電気泳動で分離したものを観察します。遺伝子を増やすってどうやるの?遺伝子って目で確認できるの?という疑問も解決しながら進んでいきますよ!
ミジンコからDNAとRNAを取り出そう!
- ミジンコ 1 匹を 1.5 ml チューブに入れ、余分な水をピペットで取りのぞきます。
- チューブに100 μl の溶解液(RA1+TCEP溶液)と、5 μl のキャリアーRNA溶液を加えてよく混ぜます。
- スピンフィルターに溶液をうつし、100 μl の 70 % エタノール入りチューブにセットします。
- 卓上遠心機で 1 分遠心し、ろ過します。ろ液はよく混ぜます。
- スピンカラムに全量を移した後、卓上遠心機で 1 分遠心します。
- ろ液を捨て、スピンカラムの内側部分を新しい 2 ml チューブにセットします。
- 400 μl のDNA Wash溶液を加え、卓上遠心機で 1 分遠心し、ろ液はすてます。これを 2 回繰り返します。
- 卓上遠心機で 1 分遠心してDNA Wash 溶液を完全に取り除き、スピンカラムの内側部分の蓋を切り取った新しい 1.5 ml チューブにセットします。
- スピンカラムの蓋を開け、3 分間静置します。
- 20 μl のDNA溶出液を加え、卓上遠心機で 2 分遠心し、DNAを回収します。
- スピンカラムの内側部分を新しい 2 ml チューブにセットします。
- 25 μl のDNA分解酵素液を加え、室温で 15 分間待ちます。
- 100 μl の RA2 溶液を加え、室温で 2 分間待ち、卓上遠心機で 1 分遠心します。
- スピンカラムの内側部分を新しい 2 ml チューブにセットします。
- 400 μl のRA3溶液を加え、卓上遠心機で 1 分遠心し、ろ液はすてます。(2 回繰り返します)
- 卓上遠心機で 1 分遠心して RA3 溶液を完全に取り除き、スピンカラムの内側部分の蓋を切り取った新しい 1.5 ml チューブにセットします。
- 蒸留水 10 μl を加え、卓上遠心機で 1 分遠心し、RNAを回収します。
PCRと逆転写PCRでミジンコのDNAとRNA(cDNA)を増やそう!
- PCR反応液・逆転写PCR反応液をつくります。
- PCR反応液 9 μl にDNA溶液 1 μl を加え、混ぜます。続いて、逆転写PCR反応液 9 μl にRNA溶液 1 μl を加え、混ぜます。
- サンプルをサーマルサイクラーにセットし、以下の条件でPCR、逆転写PCRをおこないます。
50 ℃ 30分(逆転写反応) ※逆転写PCRのみこのステップをおこないます。
▼
94 ℃ 5分(熱変成、逆転写酵素の失活)
▼
94 ℃ 30秒(熱変成)
55 ℃ 30秒(アニーリング)
72 ℃ 1分(伸長反応:DNA 合成)
※この3ステップを30サイクルおこないます。
▼
終了後、72 ℃ 7分で処理し、最後に4℃で保存します。

遺伝子を増やすPCR、逆転写PCRの仕組みついて詳しく知りたい人はこちらをみてね!
実験の補足
PCR反応液・逆転写PCR反応液はティーチングアシスタント(TA)の方が準備してくれました。反応液の成分は以下の通りです。

- PCR Master Mix にはPCR 酵素、dNTP mix(GTCAの塩基)、酵素反応に必要なMgイオン、緩衝液などがふくまれます。逆転写PCR Master Mixにはこれらに加えて逆転写酵素、RNA分解酵素阻害剤がふくまれます。
- DNAはそのままPCRの鋳型に使用します。RNAは逆転写反応によってcDNA(complementary DNA、相補的DNA、mRNAに逆転写酵素を働かせてつくったコピー)を合成し、PCRの鋳型とします。逆転写反応とその後のPCRは同一チューブ内で連続しておこないます。
ゲル電気泳動でオオミジンコとミジンコのDNAとRNA(cDNA)を比べよう!
- 逆転写PCR サンプルにローディングDye(色素)を 2 μl 入れて混ぜます。 ※PCRサンプルはMaster MixにDyeがあらかじめふくまれているので不要です。
- 2 % アガロースゲルの 1 ウェル(穴)当たりPCR反応液 5 μl をマイクロピペットで注入します。
- マーカーDNA液(100 ~ 1000 bpまで 100 bpごとのDNAを含む)は 5 μl 使用します。
- 100 V の定電圧をかけ、色素がウェルから 3 ~ 4 cm に移動するまで 30 分ほど泳動します。
- エチジウムブロマイドでDNAを染色します。
- 紫外線灯を当てて、分離したDNAを観察します。

実験メモ
- エチジウムブロマイド(臭化エチジウム)は発がん性が疑われる色素なので、DNAの染色はTAの先生が対応してくれたよ。
- どうしてDNAを分けて、目に見えるようにして観察できるんだろう?詳しい説明は、ゲル電気泳動の仕組みをみてね!


電気泳動の結果はこのようになりました。ミジンコとオオミジンコ、メスとオスとでそれぞれ比較すると、違うところと同じところが確認できました。

補足:bp(ベースペア) 。DNAの長さを表す単位。

なぜ種ごと、オスとメスごとにバンドが現れる位置が違うんだろう?
詳しい解説はPCRで増幅したDNAとRNA(cDNA)のバンドを比較を見てね!
施設見学と特別講義
体験講座の最後に、バイオサイエンス教育研究センター内の見学と蕪山(かぶやま) センター長による特別講義がありました。
バイオサイエンス教育研究センター ゲノミクス研究棟の見学
最先端の解析機器や特別な環境で生育されている遺伝子組換え生物などを見学しました。使用している機器や設備、さまざまな研究テーマについてTAの方がわかりやすく丁寧に説明してくれました。


蕪山センター長の特別講義
宇都宮大学 バイオサイエンス教育研究センター センター長の蕪山 由己人先生に特別講義をしていただきました。2日間で体験した実験の復習やその実用化例など、身近なものへ活用されているバイオテクノロジーの現状を教えていただきました。蕪山先生は、「社会における科学の役割を理解して欲しい」とおっしゃっていて、その思いは受講生にしっかりと届いたようです。
講義の最後には受講生一人一人に修了証書の授与を行いました。


参加されたみなさんの声
受講生のみなさんより
体験講座後におこなったアンケートでは、「今回の講座の内容に興味・関心が持てたか?」という質問に関して7割を超える受講生が「かなり興味を持ったので自分でも研究してみたい」と回答しました。以下に感想の一部をご紹介します。
- 高校ではできないような実験をすることができて楽しかった。
- 遺伝子組換えが身近なものに感じられ、農学の素晴らしさに改めて気づけた。
- 普段見ることの出来ない研究設備を見られ、貴重な体験ができた。
- 実験や施設見学ができて良かった。
- ミジンコに興味があるので、観察・実験できて嬉しかった
- ミジンコのことをもっとよく知りたいから自分でも研究してみたい
宮川先生より
体験講座後におこなったアンケートでは、9割の受講生が「大満足」もしくは「満足」と回答してくれてとても嬉しかったです。この結果からも、本講座の開催目的であった「最先端のバイオテクノロジーに触れてもらうことで、科学に対する興味・関心を醸成すること」は達成できたのではないかと思います。
本講座のサポート教員として蕪山由己人センター長、松田勝先生、TA として当大学の学部生 ・ 大学院生が協力してくれました。ご協力に心から感謝しています。
本講座では、受講生6名ごとに一班をつくり、最低1名のTAを配置することで事故の未然防止に努めました。TAには、実験の操作を教えるだけでなく、実験内容や講義内容について受講生に問いかけるようお願いし、受講生が自ら考えて取り組める状況をつくりました。また、2日間のプログラムにしたことで、受講生がTAとの距離を縮められたことで質問が多く出るようになったことに加えて、他校の受講生とも協力して実験に取り組みやすくなったと思います。
編集後記
2日間の体験講座を終えて、ご参加されたみなさんは、バイオサイエンスの面白さを改めて感じることができたようです。今回の体験を通して、自分の中に潜む“科学”に対する好奇心への気づき、みんなと協力しあう大切さを学んだ受講生もいたことと思います。日本の未来をになう科学者がでてきてくれたら嬉しいな、と切に思いました。
用語集&実験の補足
ゲル電気泳動の仕組み
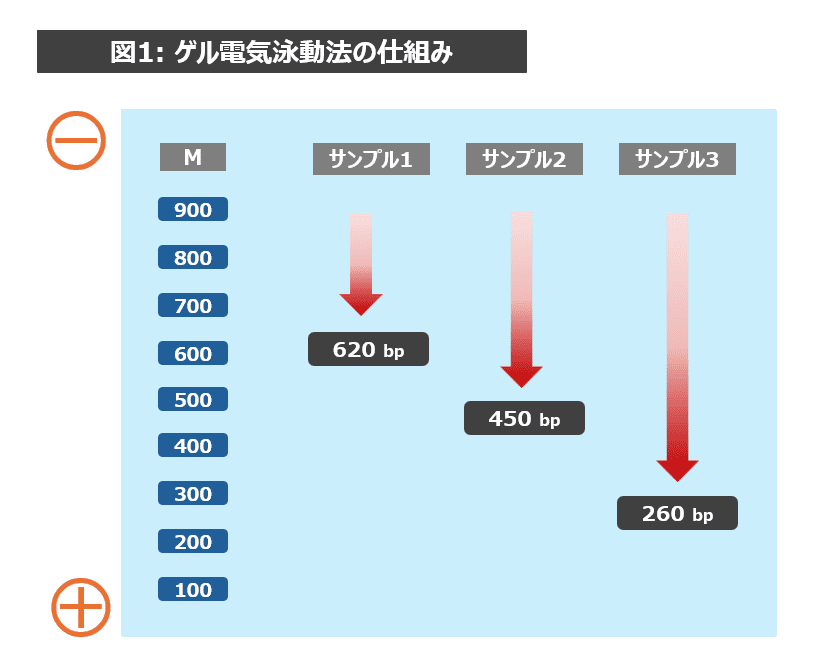
ゲル電気泳動とは、電場をかけ、DNA分子の大きさの違いを用いてDNA分子を分離する方法です。DNAは、電気的に陰性(マイナス)をおびているので、陰極(マイナス)から陽極(プラス)に向かって動きます。しかも、ゲル電気泳動ではアガロースの網目構造の中を通るため、大きな分子ほど通りにくく、小さい分子ほど通りやすいことから、移動速度に違いができ、DNA分子の大きさ(DNA の長さ)による分離が可能です。マーカーDNA液(M)と比較することで、そのサンプルに含まれるDNAの大きさがどれくらいかを確認することができます(図1参照)。
PCRで増幅したDNAとRNA(cDNA)のバンドを比較
改めて各サンプルのバンドを比べてみましょう。
DNAのバンドを比較
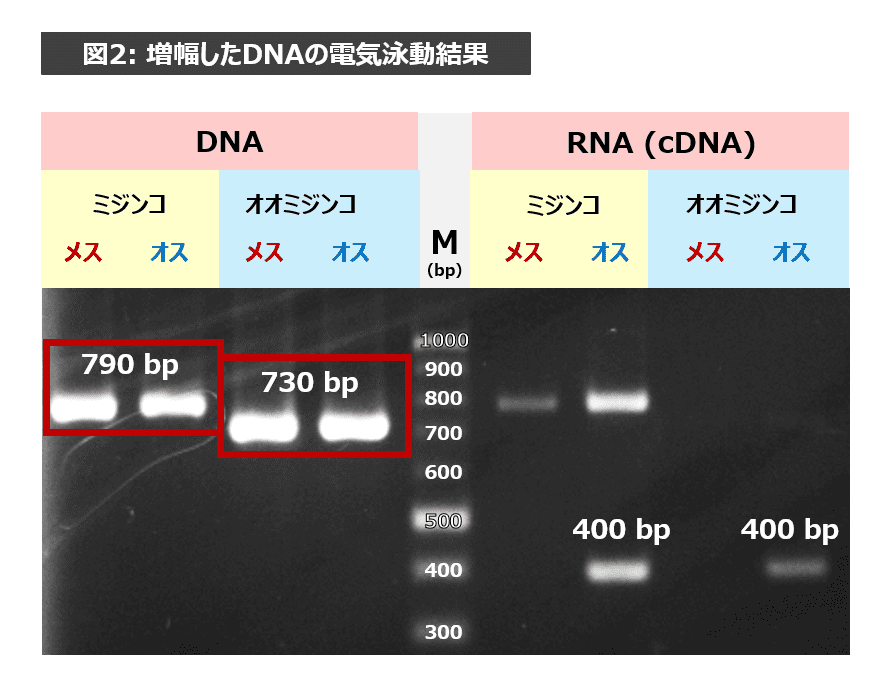
DNAについて、ミジンコとオオミジンコを比べてみましょう(図2参照)。ミジンコのメスとオスは790bp付近にバンドがでているのがわかりますね。一方、オオミジンコのメスとオスは730bp付近にバンドがでているのがわかります。種間で違いがあり、同じ種のメスとオスとでは違いがありません。
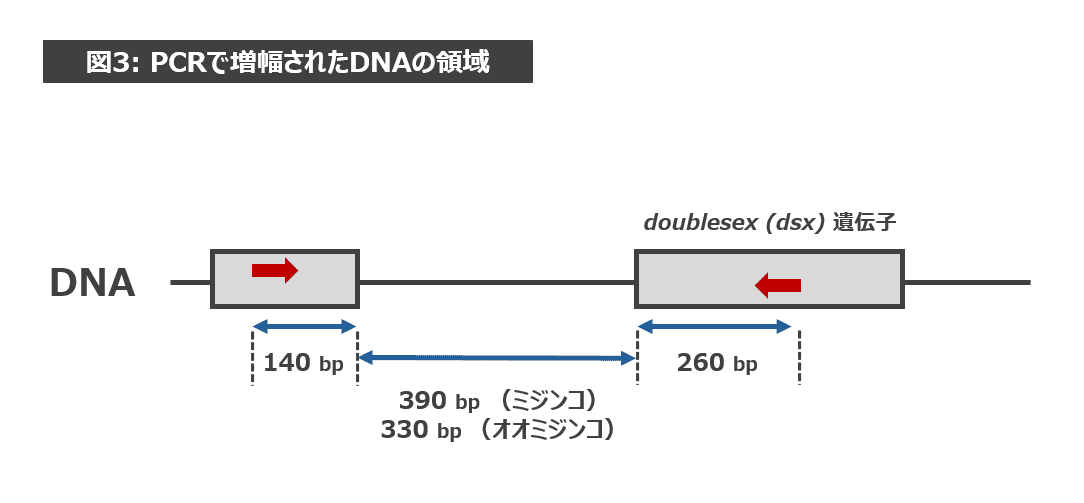
これは、今回の実験で使用したプライマーにはさまれるDNAの長さが種によって異なるからです(図2参照。プライマーの位置は赤い矢印で表示。)このため、ミジンコは 790 bp 付近にバンドが、オオミジンコは 730 bp 付近にバンドが現れたのです。
RNA(cDNA)のバンドを比較
RNA(cDNA)について、ミジンコとオオミジンコを比べてみましょう。ミジンコのオスとオオミジンコのオス、ともに 400 bp 付近にバンドがあります。種が異なるオスどうしで、同じ大きさのRNAが存在するのは興味深いですね。
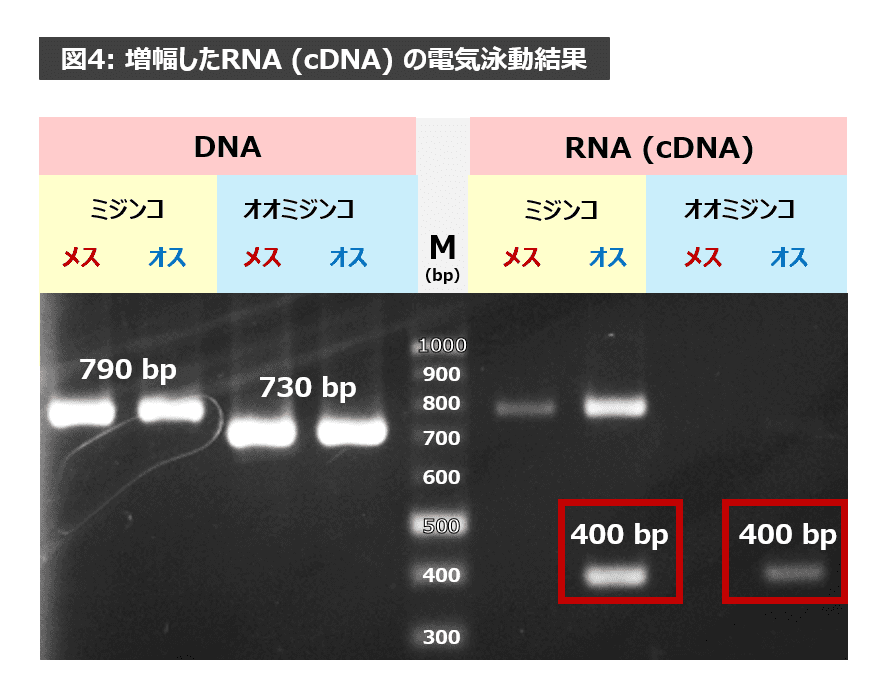
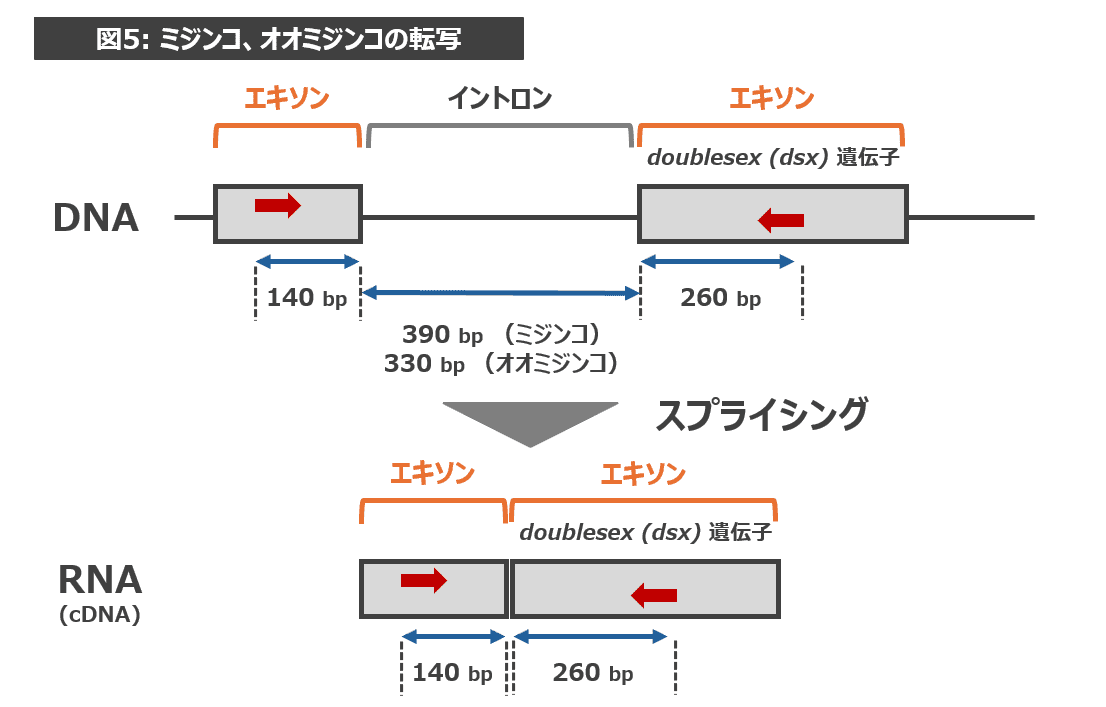
これは、DNAからRNAが転写される際におきるスプライシングと、オスのみで発現するdoublesex (dsx) 遺伝子が関係しています。
実は、DNAがRNAに転写されるとき、DNAのすべての領域が転写されるわけではありません。転写される部分(エキソン)と転写されずに除かれる部分(イントロン)が存在します。イントロンが除かれて転写がおこることをスプライシングといいます。
ミジンコ、オオミジンコのRNA(cDNA)ができる際、図5のようにスプライシングが起きたため、両方とも 400 bp 付近にバンドが出現したのです。
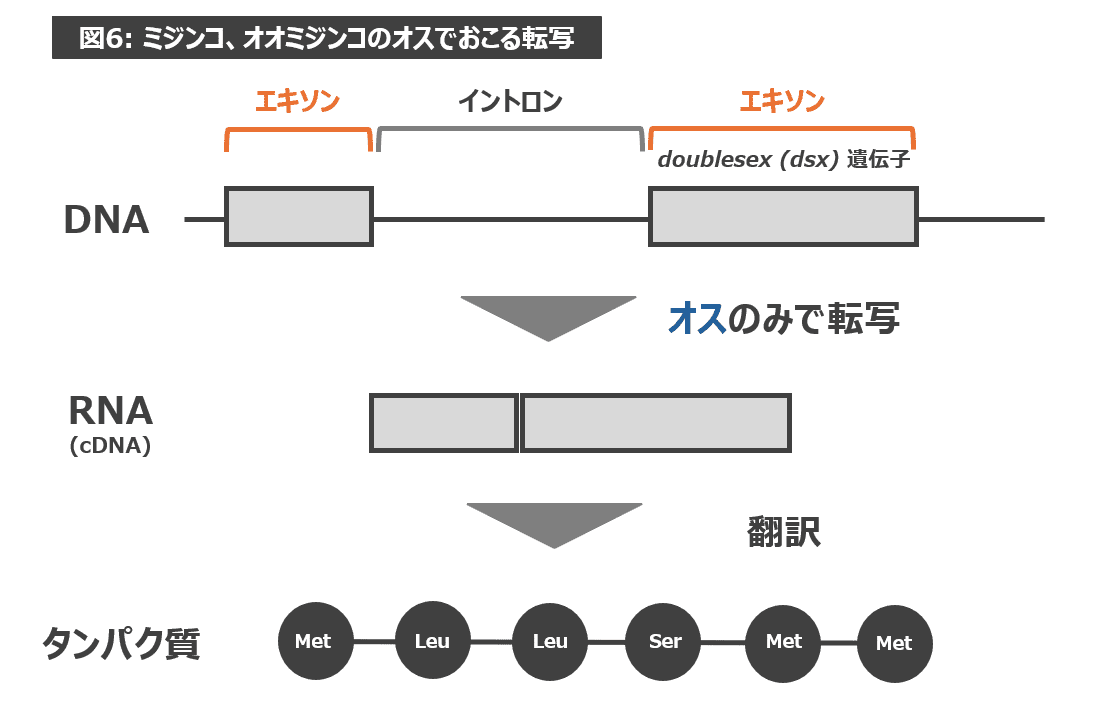
加えて、dsx遺伝子はオスのみで転写・翻訳され、オスのからだの特徴をつくります。よって、400 bp 付近のバンドはメスには現れず、オスのみで現れたのです(図6参照)。
私たちコスモ・バイオは、「生命科学の進歩に資する」ことを第一の経営理念に掲げ、皆様に信頼される企業づくりを目指しています。この理念に基づき、今回のような、大学等が実施する公開講座の支援を通して、次の世代を担う“明日の科学者”にライフサイエンスの面白さと楽しさを伝えるお手伝いをします。
情報公開日:2024年3月
掲載元:コスモ・バイオ(株)公開講座応援団



